
【题目】如图为 A、B 元素的原子结构示意图。下列说法错误的是( )

A.B 的原子结构示意图中 x 为 12
B.A 和 B 分别属于非金属元素和金属元素
C.A 的原子和 B 的原子分别形成简单离子的过程相同
D.A 与 B 可组成化学式为 BA2 的化合物
【答案】C
【解析】
A.原子中质子数等于电子数,所以B的原子核外有12个电子,则质子数是12,即x=12,故A正确;
B.A的最外层电子数是7,大于4属于非金属元素,B的最外层电子数是2,小于4,属于金属元素,故B正确;
C.A的最外层电子数是7,化学反应中易得电子,B的最外层电子数是2,化学反应中易失电子,所以A的原子和B的原子分别形成简单离子的过程不相同,故C错误;
D.A的最外层电子数是7,化学反应中易得到1个电子,而带一个单位的负电荷,化合价为﹣1价,B的最外层电子数是2,化学反应中易失掉2个电子,而带两个单位的正电荷,化合价为+2价,所以A与B可组成化学式为BA2的化合物,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】A、B是两种有刺激气味的气体。试根据下列实验事实填空。

(1)写出A~F各物质的化学式:
A__________、B__________、C__________、D__________、E__________、F__________。
(2)写出A、B跟水反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
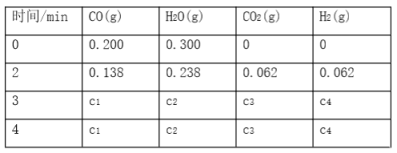
【题目】工业上制备H2的一种重要方法是:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=Q kJ·mol―1。已知该反应的平衡常数K与温度的关系如图所示。若在一固定的密闭容器中,850 ℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
CO2(g)+H2(g) ΔH=Q kJ·mol―1。已知该反应的平衡常数K与温度的关系如图所示。若在一固定的密闭容器中,850 ℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
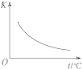
已知:850 ℃时该反应的化学平衡常数K=1.0,请回答下列问题:
(1)下列可以判断该反应达到化学平衡状态的是________。
A.单位时间内减少CO(g)的浓度等于生成CO2(g)的浓度
B.反应容器内的压强不发生变化
C.混合气体中H2(g)的浓度不再发生改变
D.氢气的生成速率等于水的消耗速率
(2)Q______0(填“>”“=”或“<”)。
(3)若在850 ℃时向反应容器中充入H2O(g),K值________________(填“增大”“减小”或“不变”)。
(4)上表中c2为________________,CO(g)的转化率为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新能源汽车的核心部件是锂离子电池,常用磷酸亚铁锂(LiFePO4)做电极材料。对LiFePO4废旧电极(含杂质Al、石墨粉)回收并获得高纯Li2CO3的工业流程图如下:

资料:碳酸锂在水中溶解度:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(1)过程i研磨粉碎的目的是_______。
(2)过程ii加入足量NaOH溶液的作用是______。
(3)过程iii采用不同氧化剂分别进行实验,均采用Li含量为3.7%的原料,控制pH为3.5,浸取1.5h后,实验结果如下表所示:
序号 | 酸 | 氧化剂 | 浸出液Li+浓度(g/L) | 滤渣中Li含量/% |
实验1 | HCl | H2O2 | 9.02 | 0.10 |
实验2 | HCl | NaClO3 | 9.05 | 0.08 |
实验3 | HCl | O2 | 7.05 | 0.93 |
①实验2中,NaClO3与盐酸反应生成黄绿色气体,大大增加了酸和氧化剂的用量,该反应的离子方程式为______。
②结合实验结果和①中的现象,最终选择H2O2作为氧化剂,原因是______。
③过程iii得到的浸出液循环两次的目的是_____。
(4)浸出液中存在大量H2PO4和HPO42,已知:H2PO4 HPO42 +H+,HPO42 PO43+H+,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因_____。
(5)对比过程iv和v,说明过程iv不用饱和Na2CO3溶液的原因______。
(6)简述过程vi的操作_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:

已知:反应Ⅰ中所有金属元素均以离子形式存在。回答下列问题:
(1)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应还原产物的化学式____。
(2)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,请写出该反应的离子方程式______。
(3)反应Ⅲ中X可以是______。(填字母代号)它的作用是______。
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(4)反应Ⅳ中电极均是惰性电极,写出阴极电极反应式_______________。
(5)已知:H2S的电离常数K1=1.0×107,K2=7.0×1015。0.1 mol/L NaHS的pH__7(填“>”“=”或“<”),理由是____。
(6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS浓度为1.0×104 mol·L1时,Mn2+开始沉淀,则a=_____。[已知:Ksp(MnS)=1.4×1015]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如下转化关系:

①A不能使酸性高锰酸钾溶液褪色
② +CO2
+CO2
③![]()
![]()
![]()
回答下列问题:
(1)A生成B的反应类型为__________,由E生成F的反应条件为_________________。
(2)D中含有的官能团名称为_________________。
(3)K的结构简式为______________________。
(4)F与银氨溶液反应的化学方程式为_____________________。
(5)F有多种同分异构体,符合下列条件的同分异构体有____________种。
①能发生水解和银镜反应
②属于芳香族化合物且分子中只有一个甲基
③具有5组核磁共振氢谱峰
(6)糠叉丙酮( )是一种重要医药中间体,参考上述合成路线,设计一条由叔丁醇((CH3)3COH)和糠醛(
)是一种重要医药中间体,参考上述合成路线,设计一条由叔丁醇((CH3)3COH)和糠醛( )为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明反应试剂和条件)___。
)为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明反应试剂和条件)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯六水氯化锶晶体(SrCl2·6H2O)可作有机合成的催化剂。用碳酸锶矿石(含少量BaCO3、FeO、SiO2等杂质)制备高纯六水氯化锶晶体的过程如图所示。
已知:

I.25℃,Ksp[Fe(OH)3]=1.0×10-38 ,Ksp[Fe(OH)2]=1.0×10-16
Ⅱ.SrCl2·6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
请回答:
(1)步骤①中将矿石制成浆液能加快反应速率的原因是_____________________________。
(2)在“浆液”中加入工业盐酸,测得锶的浸出率与温度、时间的关系如图所示:

据此合适的工业生产条件为_________________________。
(3)步骤②“溶液”中加入30%的H2O2,其作用是_____________________________(用离子方程式表示)。
(4)步骤③所得滤渣的主要成分除Fe(OH)3外,还有_______________________(填化学式);25℃,为使Fe3+沉淀完全需调节溶液pH值最小为_____________(当离子浓度减小至1.0×10-5mol·L-1时,可认为沉淀完全)。
(5)关于上述流程中各步骤的说法,正确的是___________(填标号)。
A.步骤④用60℃的热水浴加热蒸发至有晶膜出现
B.步骤④冷却结晶过程中应通入HC1气体
C.步骤⑤干燥SrCl2·6H2O晶体可以采用减压干燥
(6)为测定所得SrCl2·6H2O(Mr=267)晶体样品的纯度,设计了如下方案:称取1.10g样品溶解于适量水中,向其中加入含AgNO31.70g的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应生成沉淀的离子),C1-即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.100 mol·L-1的NH4SCN标准溶液滴定剩余的AgNO3溶液,使剩余的Ag+以AgSCN白色沉淀的形式析出,当___________时达到滴定终点,用去NH4SCN溶液20.00 mL,则原SrCl2·6H2O晶体的纯度为________________%(计算结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学是“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和无污染。
(1)下列各项符合“绿色化学”要求的是____。
A.处理废弃物 B.治理污染点 C.减少有毒物 D.杜绝污染源
(2)在我国西部大开发中,某地为筹建一大型化工基地,征集到下列方案,其中你认为可行的是____。
A.建在西部干旱区可以脱贫致富
B.应建在水资源丰富和交通方便且远离城市的郊区
C.企业有权自主选择厂址
D.不宜建在人口稠密的居民区
(3)某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子。某同学设计了从该污水中回收纯净的金属铜的方案。

在能制得纯铜的方案中,哪一步操作会导致环境污染?___。应增加哪些措施防止污染______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钼具有高强度、高熔点、耐磨抗腐性,用于制火箭、卫星的合金构件。钼酸钠晶体(Na2MoO42H2O)是一种重要的金属缓蚀剂。利用钼矿(主要成分MoS2,还含少量钙、镁等元素)为原料冶炼金属钼和钼酸钠晶体的主要流程图如下:
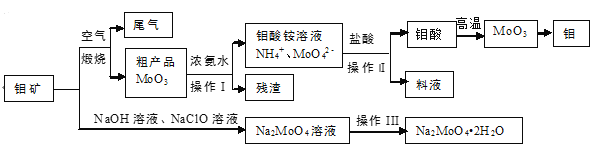
(1)Na2MoO42H2O中钼元素的价态为___,煅烧产生的尾气引起的环境危害主要是_______。
(2)用浓氨水溶解粗产品的离子方程式是_________,由图中信息可以判断MoO3是___氧化物。(填“酸性”、“碱性”或“两性”)
(3)操作I是_____,操作Ⅱ所得的钼酸要水洗,检验钼酸是否洗涤干净的方法是____。
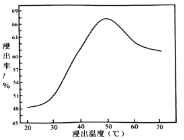
(4)采用 NaClO氧化钼矿的方法将矿石中的钼浸出,该过程放热。
①请配平以下化学反应:
___NaClO +___MoS2 + ___NaOH →___Na2MoO4 +___Na2SO4 +___NaCl +___H2O。
②钼的浸出率随着温度变化如图,当温度高于50℃后浸出率降低的可能原因是______(写一点)。
(5)锂和MoS2可充电电池的工作原理为xLi+nMoS2![]() Lix(MoS2)n,则电池充电时阳极上的电极反应式为______。
Lix(MoS2)n,则电池充电时阳极上的电极反应式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com