
【题目】如图所示为冰晶石(化学式为Na3AlF6)的晶胞。己知冰晶石熔融时电离方程式为:Na3AlF6![]() 3Na++AlF63-。图中●位于大立方体顶点和面心,○位于大立方体的12 条棱的中点和8个小立方体的体心。则下列说法正确的是( )
3Na++AlF63-。图中●位于大立方体顶点和面心,○位于大立方体的12 条棱的中点和8个小立方体的体心。则下列说法正确的是( )
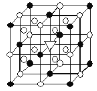
A. 冰晶石是原子晶体 B. 该物质中存在配位键
C. 大立方体的体心处△代表的是Al3+ D. 该物质是电解冶炼铝的还原剂
【答案】B
【解析】A、由已知冰晶石熔融时电离方程式为:Na3AlF6![]() 3Na++
3Na++![]() 可知,冰晶石是离子晶体,故A错误;B、Al的最外层含有三个电子,能与三个F形成三个共价键,而
可知,冰晶石是离子晶体,故A错误;B、Al的最外层含有三个电子,能与三个F形成三个共价键,而![]() 中Al结合了6个F,说明
中Al结合了6个F,说明![]() 中Al和F之间形成了三个配位键,其中Al提供空轨道,F提供孤对电子,故B正确;C、由冰晶石(化学式为Na3AlF6)可知,Na+与
中Al和F之间形成了三个配位键,其中Al提供空轨道,F提供孤对电子,故B正确;C、由冰晶石(化学式为Na3AlF6)可知,Na+与![]() 的个数比为3:1,由冰晶石的晶胞结构可知,一个晶胞中含有●的个数为8×
的个数比为3:1,由冰晶石的晶胞结构可知,一个晶胞中含有●的个数为8×![]() + 6×
+ 6×![]() = 4,○的个数为8+12×
= 4,○的个数为8+12×![]() =11,△代表○时,●与○的个数比为1:3,则●为
=11,△代表○时,●与○的个数比为1:3,则●为![]() ,○为Na+,所以大立方体的体心处△代表的是Na+,故C错误;D、该物质是电解冶炼铝的助熔剂,故D错误。
,○为Na+,所以大立方体的体心处△代表的是Na+,故C错误;D、该物质是电解冶炼铝的助熔剂,故D错误。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 3.2 gO2和O3的混合气体中,含氧原子数为0. 2NA
B. 标准状况下,2. 24 L的Cl2溶于水,久置最终可生成O2分子数为0. 05 NA
C. 标准状况下,22.4 L的CHCl3含有碳氯键3 NA
D. 1 mol苯乙烯分子中含有的碳碳双键数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A. pH=1的溶液中:Fe2+、NO![]() 、Na+、SO
、Na+、SO![]()
B. 水电离出的c(H+)=10-12 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO![]()
C. ![]() =1012的水溶液中:NH
=1012的水溶液中:NH![]() 、Al3+、NO
、Al3+、NO![]() 、Cl-
、Cl-
D. c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO![]() 、SCN-
、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是制作电子集成电路的基础材料。科学家预计,到2011年一个电脑芯片上将会集成10亿个晶体管,其功能远比我们想象的要大的多,这对硅的纯度要求很高.用化学方法可制得高纯度硅,其化学方程式为:( )
①SiO2+2C![]() Si+2CO↑ ②Si+2Cl2
Si+2CO↑ ②Si+2Cl2![]() SiCl4 ③SiCl4+2H2
SiCl4 ③SiCl4+2H2![]() Si+4HCl,
Si+4HCl,
下列对上述三个反应的叙述中,不正确的是( )
A. ①③为置换反应 B. ②为化合反应
C. ①②③均为氧化还原反应 D. 三个反应的反应物中硅元素均被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一瓶久置的Na2SO3固体试剂,已部分变质,为测定其纯度,实验设计与操作如下,请回答问題:
(1)Na2SO3变质的原因(用化学方程式表示)___________。
(2)取一定量的样品溶于水,加入过量的BaCl2溶液,然后过滤(如图)、洗涤、干燥、称量,其中洗涤沉淀的具体操作为___________。
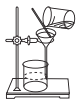
(3)实验时用BaCl2比用CaCl2好,写出两点理由:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铁与氯化铁溶液反应:Fe+Fe3+===2Fe2+
B. 向次氯酸钙溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO
C. 实验室用MnO2和浓盐酸制取Cl2: MnO2+4HCl(浓)![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
D. 向NH4HCO3溶液中加过量的NaOH溶液:NH![]() +OH-===NH3↑+H2O
+OH-===NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水里(水的密度近似为lg/mL),所得溶液的密度为ρg/mL,质量分数为![]() ,物质的量浓度c mol/L,则下列关系中不正确的是( )
,物质的量浓度c mol/L,则下列关系中不正确的是( )
A. ρ= (17V+22400)/ (22.4+22.4V ) B. ![]() = 17c/(1000ρ)
= 17c/(1000ρ)
C. ![]() = 17V/ (17V+22400) D. c= 1000Vρ/(17V+22400)
= 17V/ (17V+22400) D. c= 1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 少量 SO2通入过量次氯酸钠溶液中:SO2+ ClO-+H2O===SO![]() +Cl-+2H+
+Cl-+2H+
B. 钠投入硫酸铜溶液中:2Na + Cu2+===Cu + 2Na+
C. 碳酸氢钠与氢氧化钠溶液混合:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
D. 硫酸镁溶液与氢氧化钡反应:SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质和该性质的应用均正确的是( )
A.SiO2是酸性氧化物,可制成玻璃容器盛装氢氟酸
B.氧化铁为红棕色固体,可用于作油漆红色涂料
C.次氯酸有酸性,可用于自来水的杀菌消毒
D.钠具有金属活泼性,钠可以从硫酸铜溶液中置换出金属铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com