
| A. | 氯气溶于水中:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 硫酸氢钠溶液与氢氧化钡溶液混合至混合液呈中性:2HSO4-+Ba2++2OH-=BaSO4↓+2H2O+SO42- | |
| C. | 向双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O | |
| D. | 用铜作阳极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ |
分析 A.次氯酸为弱酸应保留化学式;
B.硫酸氢钠与氢氧化钡二者按照物质的量之比为2:1反应溶液呈中性;
C.过氧化氢具有氧化性能够氧化单质碘;
D.铜作阳极,铜失去电子发生氧化反应.
解答 解:A.氯气溶于水中,离子方程式:Cl2+H2O=H++Cl-+HClO,故A错误;
B.硫酸氢钠溶液与氢氧化钡溶液混合至混合液呈中性,离子方程式:2H++SO4-+Ba2++2OH-=BaSO4↓+2H2O,故B错误;
C.向双氧水中加入稀硫酸和KI溶液,离子方程式:H2O2+2H++2I-=I2+2H2O,故C正确;
D.用铜电极电解Cu(NO3)2溶液,离子方程式:Cu+2H20$\frac{\underline{\;通电\;}}{\;}$Cu2++4H++O2↑,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意电解池离子方程式书写应注意阳极是否是活性电极,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ⑤②④③① | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ①④②⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在外电路中,电子由银电极流向铜电极 | |
| B. | 取出盐桥后,电流计的指针仍发生偏转 | |
| C. | 外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g | |
| D. | 原电池的总反应式为Cu+2AgNO3=2Ag+Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
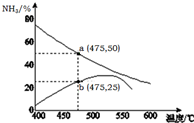 氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.
氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 既能与酸又能与碱反应的物质一定是两性氧化物或两性氢氧化物 | |
| B. | 往Fe(OH)3胶体中逐滴加入稀H2SO4溶液时,开始时会出现沉淀,再继续滴加时,沉淀又会消失 | |
| C. | 胶体区别于其他分散系的本质特征是丁达尔现象 | |
| D. | 某物质溶于水后所得溶液能导电,该物质一定属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g O2中含有的分子数为NA | |
| B. | 标准状况下,22.4 L H2O中含有的分子数为NA | |
| C. | 1 mol Mg与足量O2反应转移的电子数为NA | |
| D. | 1 mol钠原子中含有的电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com