
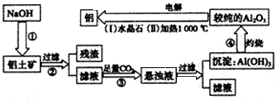
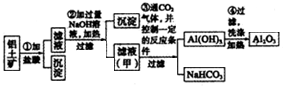


科目:高中化学 来源: 题型:
| A、FeCl3溶液有杀菌消毒作用 |
| B、FeCl3溶液能使血液聚集沉降 |
| C、FeCl3溶液能产生Fe(OH)3沉淀堵住伤口 |
| D、FeCl3能使血液发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
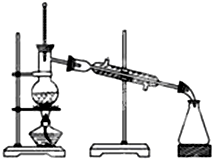 地球是一个巨大的生态系统,森林对保护改善人类的生存环境有着十分重要的作用.科学实验证明,1公顷柳杉林每月可以吸收SO2160kg,试解答下列问题:
地球是一个巨大的生态系统,森林对保护改善人类的生存环境有着十分重要的作用.科学实验证明,1公顷柳杉林每月可以吸收SO2160kg,试解答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2 |
| B、NaOH |
| C、H2S |
| D、AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
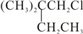 .B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示.
.B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示.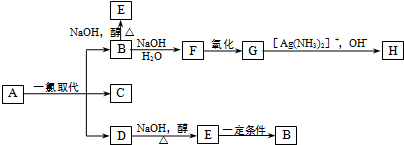
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、脱氧过程是吸热反应映,可降低温度,延长糕点保质期 |
| B、脱氧过程中铁作原电池负极,电极反应为:Fe-3e-═Fe3+ |
| C、脱氧过程中碳做原电池正极,电极反应为:O2+4 e-+4H+═2H2O |
| D、含有2.24g铁粉的脱氧剂,理论上最多能吸收氧气672 mL(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:
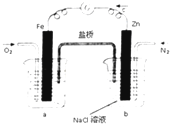
| A、烧杯a中的溶液pH减小 |
| B、烧杯b中发生氧化反应 |
| C、烧杯a中发生的反应为2H++2e-=H2↑ |
| D、烧杯b中发生的反应为2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等于50mL |
| B、大于50mL |
| C、等于100mL |
| D、大于100mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com