
| A、等于50mL |
| B、大于50mL |
| C、等于100mL |
| D、大于100mL |
| ||
| ||
| 1.8mol |
| 18mol/L |


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案科目:高中化学 来源: 题型:
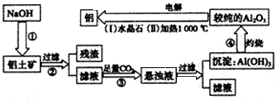
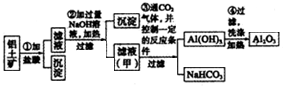
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸的摩尔质量与NA个硫酸分子的质量在数值上相等 |
| B、NA个氧分子与NA个氢分子的质量比等于16:1 |
| C、28克氮气所含原子数为4NA |
| D、标准状况下,0.5NA个氯分子所占体积为11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5molH2O2中含有6.02×1023个质子 |
| B、1molC5H12分子中含有17×6.02×1023个共用电子对 |
| C、质量均为16g 的O2和O3中都含有6.02×1023个原子 |
| D、标准状况下,11.2LHCl中含6×6.02×1023个离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙、丙、丁、戊五种前四周期元素,其中甲乙丙都为非金属元素,在周期表中的位置关系如图1所示.丁、戊两种元素则位于同一周期同一族,而且戊的原子序数比丁大2.
甲、乙、丙、丁、戊五种前四周期元素,其中甲乙丙都为非金属元素,在周期表中的位置关系如图1所示.丁、戊两种元素则位于同一周期同一族,而且戊的原子序数比丁大2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com