
【题目】如图所示进行实验,下列说法不正确的是( ) 
A.装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生
B.甲、乙装置中的能量变化均为化学能转化为电能
C.装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转
D.装置乙中负极的电极反应式:Zn﹣2e﹣═Zn2+
【答案】B
【解析】解:A、装置甲的锌片与硫酸反应生成硫酸锌和氢气,装置乙中锌片、铜片和稀硫酸组成的原电池装置中,铜片作正极,正极上氢离子得电子发生还原反应,所以甲的锌片上和装置乙的铜片上均可观察到有气泡产生,故A正确;B、装置甲的锌片与硫酸反应生成硫酸锌和氢气没有形成原电池,故B错误;
C、装置乙中锌片、铜片和稀硫酸组成的原电池装置中,所以锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转,故C正确;
D、装置乙中锌片、铜片和稀硫酸组成的原电池装置中,锌片的活泼性大于铜片的活泼性,所以锌片作负极,负极上锌失电子发生氧化反应,电极反应式:Zn﹣2e﹣═Zn2+ , 故D正确.
故选B.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(稀溶液混合时体积可直接相加)。下列判断错误的是

A. 由图中信息可知,HA一定是强酸
B. 当V(MOH)=50.00 mL时,混合溶液中c(M+)+c(MOH)=0.01 mol·L-1
C. N点对应的溶液中c(M+)=c(A-)
D. K点所对应的溶液中离子浓度大小关系为:c(M+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用浓度为0.1000molL﹣1的NaOH溶液分别逐滴加入到20.00mL 0.1000molL﹣1的HX,HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( ) 
A.V(NaOH)=10.00 mL时,c(X﹣)>c(Na+)>c(H+)>c(OH﹣)
B.V(NaOH)=20.00 mL时,两份溶液中,c(X﹣)>c(Y﹣)
C.V(NaOH)=20.00 mL时,c(Na+)>c(X﹣)>c(OH﹣)>c(H+)
D.pH=7时,两份溶液中,c(X﹣)=c(Y﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氦原子电子云图的说法正确的是( )
A.通常用小黑点来表示电子的多少,黑点密度大,电子数目大
B.黑点密度大小,表示单位体积内电子出现的机会多少
C.通常用小黑点来表示电子绕核作高速圆周运动
D.电子云图是对运动无规律性的描述
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量.某兴趣小组用下图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去). 
(1)【背景素材】
①2NO+Na2O2═2NaNO2;
②NO能被酸性KMnO4氧化成NO3﹣ , MnO4﹣被还原为Mn2+ .
③在酸性条件下NaNO2能把I﹣氧化为I2;S2O32﹣能把I2还原为I﹣ .
【制备NaNO2】
(i)装置A三颈烧瓶中发生反应的化学方程式为 .
(ii)B装置的目的是① , ② .
(iii)为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是(填序号).
A.P2O5 B.碱石灰 C.无水CaCl2 D.生石灰
(iv)E装置的作用是 .
(2)【测定NaNO2纯度】
可供选择的试剂有:
A.稀硫酸 B.c1 molL﹣1 KI溶液 C.淀粉溶液 D.c2 molL﹣1 Na2S2O3溶液
E.c3 molL﹣1酸性KMnO4溶液
①利用NaNO2的还原性来测定其纯度,可选择的试剂是(填序号).
②利用NaNO2的氧化(请补充完整实验步骤).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如图所示,下列有关该物质的说法正确的是( )
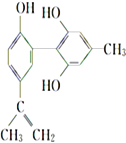
A. 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B. 该分子中的所有碳原子一定共平面
C. 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为4 mol、7 mol
D. 滴入KMnO4酸性溶液,观察到紫色褪去,能证明结构中存在碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3、MaHCO3及xNa2CO3·yH2O(过碳酸的)在工农业生产上用途非常广泛。
(1)0.1mol/LNa2CO3溶液加水稀释时,溶液的pH____ (填“增大”、“减小”或“不变”)。
(2)25℃时,H2CO3的电离常数Ka1=5×10-7,Ka=5×10-11,NH3·H2O的电离常数Kb=1.8×10-5,计算下列平衡常数。
①NaHCO3水解反应HCO3-+H2O![]() H2CO3+OH-的平衡常数为K= ________ 。(填数值)
H2CO3+OH-的平衡常数为K= ________ 。(填数值)
②反应HCO3-+NH3·H2O![]() CO32-+NH4++H2O的平衡常数为K=_________。 (填数值)
CO32-+NH4++H2O的平衡常数为K=_________。 (填数值)
(3)一种测定xNa2CO3·yH2O2中y/x值的方法如下:

①滴定CO32-时,终点溶液颜色变化是______。
②滴定H2O2时,MnO4-被还原为Mn2+,反应的离子方程式为_______。
③若消耗盐酸25.00mL,消耗KMnO4溶液19.00mL。y/x的值(列出计算过程)__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com