
【题目】某烟气研究组采用尿素H2N(CO)NH2溶液在50~700C时进行脱硫脱硝,装置如图所示。
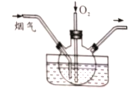
(1)如果不通入氧气,发现只有少量的烟气被吸收,生成对环境友好的物质。 被吸收的气体为___________ ;发生反应的化学方程式为__________________。
(2)如果通人烟气和一定量氧气的混合气,氮氧化物的吸收率仍然较低,可能的原因是____________________________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.苯和四氯化碳都能使溴水褪色,但现象不同
B.甲烷与氯气在光照下最多能生成四种产物
C.邻二甲苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构
D.相同物质的量的乙醇和乙烯,消耗的氧气的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3—CH=CH2+HBr→CH3—CHBr—CH3(主要产物),1 mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下面所示的一系列变化。
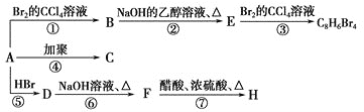
(1)A的化学式:________,A的结构简式________。
(2)上述反应中,①是________反应,⑦是________反应。(填反应类型)
(3)写出C,D,E,H物质的结构简式:
C_________,D_________,E_______,H________。
(4)写出DF反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A(g)![]() B(g)+D(g),在四种不同条件下进行,投入反应物A,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g),在四种不同条件下进行,投入反应物A,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:

根据上述数据,完成下列填空:
(1)在实验1,反应在20至30分钟时间内平均速率为_____mol/(L·min)。
(2)在实验2,反应经20分钟就达到平衡的原因可能是______。A的初始浓度C2______1.0mol/L(填>、=、<)。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3____V1(填>、=、<),且C3___1.0mol/L(填>、=、<)。
(4)从实验4可推测该反应是____反应(选填“吸热”“放热”)。理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据门捷列夫的元素周期表,人们总结出下面的元素化学性质的变化规律。该表中元素化学性质的变化表明( )
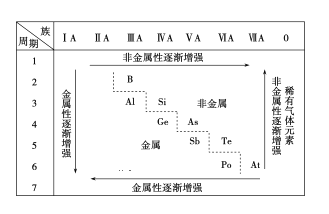
A.同周期元素的性质是相似的
B.元素周期表中最右上角的氦元素是非金属性最强的元素
C.第ⅠA族元素的金属性肯定比同周期的第ⅡA族元素的金属性弱
D.物质量变到一定程度必然引起质变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成。
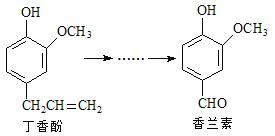
有关上述两种化合物的说法正确的是
A. 常温下,1mol丁香酚只能与1molBr2反应
B. 丁香酚不能使FeCl3溶液发生显色反应
C. 1mol香兰素最多能与3mol氢气发生加成反应
D. 香兰素分子中至少有12个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作会使最终结果偏高的是( )
A.配制![]() 溶液,定容时俯视刻度线
溶液,定容时俯视刻度线
B.用![]() 盐酸滴定
盐酸滴定![]() 溶液,起始读数时仰视
溶液,起始读数时仰视
C.用湿润的pH试纸测定![]() 溶液的pH
溶液的pH
D.测定中和热的数值时,将![]() 溶液倒入盐酸后,立即读数
溶液倒入盐酸后,立即读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了日本吉野彰等三人,以表彰他们对锂离子电池研发的卓越贡献。
(1)自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷锂铝石等。为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈________,可以认为存在锂元素。
A.紫红色 B.紫色 C.黄色
(2)工业中利用锂辉石(主要成分为LiAlSi2O6,还含有FeO、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如下:
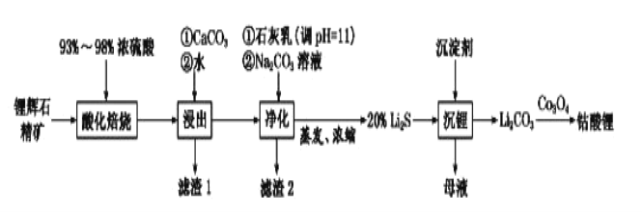
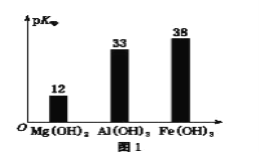
已知:部分金属氢氧化物的pKsp(pKsp=-lgKsp)的柱状图如图1。
回答下列问题:
①锂辉石的主要成分为LiAlSi2O6,其氧化物的形式为________。
②为提高“酸化焙烧”效率,常采取的措施是________。
③向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为_______。(保留到小数点后一位。已知:完全沉淀后离子浓度低于1×l0-5)mol/L)
④常温下,已知Ksp[ Mg(OH)2]=3.2×10-11mol/L,Ksp[Fe(OH)3]=2.7×10﹣39,若将足量的Mg(OH)2和Fe(OH)3分别投入水中均得到其相应的悬浊液,所得溶液中金属阳离子的浓度分别为____________mol/L、__________mol/L。
⑤“沉锂”过程所获得的“母液”中仍含有大量的Li+,可将其加入到“___________”步骤中。
⑥Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为__________
(3)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LiCoO2+C6 ![]() LixC6+Li1-xCoO2 ,其工作原理如图2。
LixC6+Li1-xCoO2 ,其工作原理如图2。
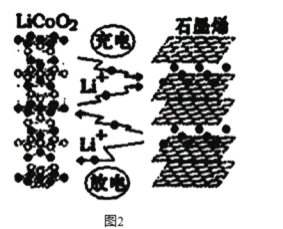
下列关于该电池的说法正确的是___________(填字母)。
A.电池反应式中过程1为放电过程
B.该电池若用隔膜可选用质子交换膜
C.石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
D.充电时,LiCoO2 极发生的电极反应为LiCoO2-xe-=xLi++Li1-xCoO2
E.对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )
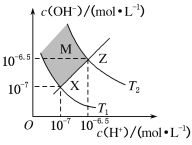
A.两条曲线间任意点均有c(H+)·c(OH-)=Kw
B.M区域内任意点均有c(H+)<c(OH-)
C.XZ线上任意点均有pH=7
D.图中T1<T2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com