
【题目】某化学反应2A(g)![]() B(g)+D(g),在四种不同条件下进行,投入反应物A,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g),在四种不同条件下进行,投入反应物A,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:

根据上述数据,完成下列填空:
(1)在实验1,反应在20至30分钟时间内平均速率为_____mol/(L·min)。
(2)在实验2,反应经20分钟就达到平衡的原因可能是______。A的初始浓度C2______1.0mol/L(填>、=、<)。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3____V1(填>、=、<),且C3___1.0mol/L(填>、=、<)。
(4)从实验4可推测该反应是____反应(选填“吸热”“放热”)。理由是____________。
【答案】0.010mol/(L·min) 反应中使用了催化剂 = > = 吸热 两实验的起始浓度相同,反应温度不同,达平衡时实验4的A的浓度小,说明了实验4 A进行的程度大,即温度越高,A的转化率越大,说明正反应为吸热反应
【解析】
(1)根据υ=![]() 及表格中的数据来计算反应速率;
及表格中的数据来计算反应速率;
(2)根据反应速率判断反应中使用了催化剂;
(3)根据反应的变化量推断v3>v1;
(4)根据温度的变化判断反应为吸热反应还是放热反应。
(1)在实验1,反应在20至30分钟时间内平均速率为υ=![]() =
=![]() =0.010mol/(L·min);
=0.010mol/(L·min);
(2)因实际反应的速率快,达平衡所需时间短,说明反应中使用了催化剂;对比实验1与实验2可知,反应温度相同,达平衡时的A的浓度相同,说明是同一平衡状态,即c2=1.0 mol/L;
(3)对比实验3与实验1可知,从10min到20min,实验1的A的浓度变化值为0.13 mol/L,而实验3的A的浓度变化值为0.17 mol/L,这就说明了v3>v1;
又知温度相同时平衡常数相同,根据平衡时A的深度可知,起始时A的浓度相同,即c3=1.0mol/L;
(4)对比实验4与实验1可知,两实验的起始浓度相同,反应温度不同,达平衡时实验4的A的浓度小,说明了实验4 A进行的程度大,即温度越高,A的转化率越大,说明正反应为吸热反应。


科目:高中化学 来源: 题型:
【题目】5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:
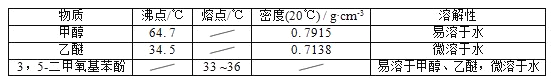
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的______;②萃取用到的分液漏斗使用前需__________________并洗净,分液时有机层在分液漏斗的________填(“上”或“下”)层;
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是______;
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母);
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先________________,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家们合成了一种新物质——五星烷,其键线式如图所示。下列有关五星烷的说法正确的是( )

A. 五星烷与乙烷互为同系物 B. 五星烷的化学式为C15H20
C. 五星烷的分子中含有7个五元环 D. 五星烷的一氯代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,浓度均为1mol·L-1的A2和B2两种气体,在密闭容器内反应生成气体C,反应达平衡后,测得:c(A2)=0.58 mol·L-1,c(B2)=0.16 mol·L-1,c(C)=0.84 mol·L-1,则该反应的正确表达式为( )
A.2A2+B2![]() 2A2BB.A2+B2
2A2BB.A2+B2![]() 2ABC.A2+B2
2ABC.A2+B2![]() A2B2D.A2+2B2
A2B2D.A2+2B2![]() 2AB2
2AB2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂是制作电池的材料,其制备过程可以简化成如图所示。下列说法错误的是( )
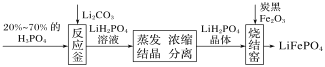
A.蒸发需要的硅酸盐材料仪器有:烧杯、酒精灯、玻璃棒、泥三角
B.反应釜中反应的化学方程式为2H3PO4+Li2CO3=2LiH2PO4+H2O+CO2↑
C.分离的操作是过滤
D.烧结窑中氧化铁与炭黑发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH固体分别加入浓度均为0.1 mol·L-1、体积均为100 mL的两种一元酸HX、HY的溶液中,lg![]() 随加入NaOH的物质的量的变化情况如图所示。下列叙述正确的是( )
随加入NaOH的物质的量的变化情况如图所示。下列叙述正确的是( )
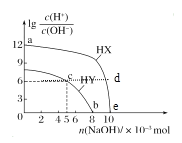
A.由a点到e点水的电离程度先增大后减小
B.d点溶液中存在:c(HX)+c(X-)=0.1mol/L
C.c点溶液中存在:c(Y-)+2c(OH-)=2c(H+)+c(HY)
D.b点溶液中存在:c(HY)+c(Na+)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烟气研究组采用尿素H2N(CO)NH2溶液在50~700C时进行脱硫脱硝,装置如图所示。
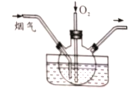
(1)如果不通入氧气,发现只有少量的烟气被吸收,生成对环境友好的物质。 被吸收的气体为___________ ;发生反应的化学方程式为__________________。
(2)如果通人烟气和一定量氧气的混合气,氮氧化物的吸收率仍然较低,可能的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是第四周期ⅥA族元素,是人体内不可或缺的微量元素,其氢化物H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的基础原料。
(1)已知:①2H2Se(g)+O2(g)![]() 2Se(s)+2H2O(l) ΔH1=a kJ·mol1
2Se(s)+2H2O(l) ΔH1=a kJ·mol1
②2H2(g)+O2(g)= 2H2O(l) ΔH2=b kJ·mol1
反应H2(g)+Se(s)![]() H2Se(g)的反应热ΔH3=___________kJ·mol1(用含a、b的代数式表示)。
H2Se(g)的反应热ΔH3=___________kJ·mol1(用含a、b的代数式表示)。
(2)T℃时,向一恒容密闭容器中加入3molH2和lmolSe,发生反应H2(g)+Se(s)![]() H2Se(g)。
H2Se(g)。
①下列情况可判断反应达到平衡状态的是___________(填字母)。
a.气体的密度不变 b.υ(H2)=υ(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
②当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为液体H2Se,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高。请用化学平衡理论解释_________________________________。
③以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如下图所示:
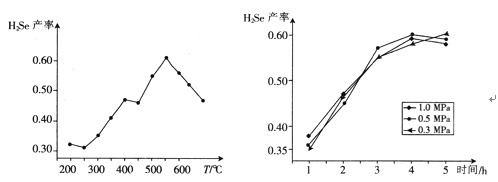
则制备H2Se的最佳温度和压强为______________________。
(3)已知常温下H2Se的电离平衡常数K1=1.3×104,K2=5.0×1011,则NaHSe溶液呈___________(填“酸性”或“碱性”),该溶液中的物料守恒关系式为____________________。
(4)用电化学方法制备H2Se的实验装置如下图所示:
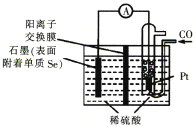
写出Pt电极上发生反应的电极反应式:_________________________________。
(5)H2Se在一定条件下可以制备CuSe,已知常温时CuSe的Ksp=7.9×1049,CuS的Ksp=1.3×1036,则反应CuS(s)+Se2-(aq)![]() CuSe(s)+S2-(aq)的化学平衡常数K=________(保留2位有效数字)。
CuSe(s)+S2-(aq)的化学平衡常数K=________(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物K是某药物的合成中间体,其合成路线如图所示:

已知:①HBr与不对称烯桂加成时,在过氧化物作用下,则卤原子连接到含氢较多的双键碳上;
②R—CN![]() R-CH2NH2(R表示坯基);
R-CH2NH2(R表示坯基);
③R1—CN2+R-COOC2H5![]()
![]() +C2H5OH(R表示烃基或氢原子)。
+C2H5OH(R表示烃基或氢原子)。
请回答下列问题:
(1)C的化学名称为_______________。
(2)D→E的反应类型为_________,F中官能团的名称是____________。
(3)G→H的化学方程式为____________________。
(4)J的分子式为__________________。手性碳原子是指与四个各不相同原子或基团相连的碳原子,则K分子中的手性碳原子数目为_______。
(5)L是F的同分异构体,则满足下列条件的L的结构简式为____________。(任写一种结构即可)
①lmolL与足量的NaHCO3溶液反应能生成2molCO2;
②L的核磁共振氢谱有3组峰且峰面积之比为1:2:3。
(6)请写出J经三步反应合成K的合成路线:____________________(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com