
【题目】硒(Se)是第四周期ⅥA族元素,是人体内不可或缺的微量元素,其氢化物H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的基础原料。
(1)已知:①2H2Se(g)+O2(g)![]() 2Se(s)+2H2O(l) ΔH1=a kJ·mol1
2Se(s)+2H2O(l) ΔH1=a kJ·mol1
②2H2(g)+O2(g)= 2H2O(l) ΔH2=b kJ·mol1
反应H2(g)+Se(s)![]() H2Se(g)的反应热ΔH3=___________kJ·mol1(用含a、b的代数式表示)。
H2Se(g)的反应热ΔH3=___________kJ·mol1(用含a、b的代数式表示)。
(2)T℃时,向一恒容密闭容器中加入3molH2和lmolSe,发生反应H2(g)+Se(s)![]() H2Se(g)。
H2Se(g)。
①下列情况可判断反应达到平衡状态的是___________(填字母)。
a.气体的密度不变 b.υ(H2)=υ(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
②当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为液体H2Se,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高。请用化学平衡理论解释_________________________________。
③以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如下图所示:
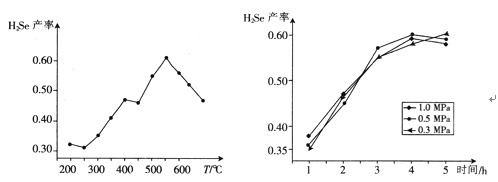
则制备H2Se的最佳温度和压强为______________________。
(3)已知常温下H2Se的电离平衡常数K1=1.3×104,K2=5.0×1011,则NaHSe溶液呈___________(填“酸性”或“碱性”),该溶液中的物料守恒关系式为____________________。
(4)用电化学方法制备H2Se的实验装置如下图所示:
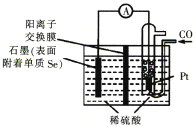
写出Pt电极上发生反应的电极反应式:_________________________________。
(5)H2Se在一定条件下可以制备CuSe,已知常温时CuSe的Ksp=7.9×1049,CuS的Ksp=1.3×1036,则反应CuS(s)+Se2-(aq)![]() CuSe(s)+S2-(aq)的化学平衡常数K=________(保留2位有效数字)。
CuSe(s)+S2-(aq)的化学平衡常数K=________(保留2位有效数字)。
【答案】![]() (ba) ad 将分离出的H2重新通入容器中,平衡正向移动,Se的转化率提高 550℃,0.3 MPa 碱性 c(Na+)=c(HSe)+c(Se2)+c(H2Se) CO2e+H2O=CO2+2H+ 1.6×1012
(ba) ad 将分离出的H2重新通入容器中,平衡正向移动,Se的转化率提高 550℃,0.3 MPa 碱性 c(Na+)=c(HSe)+c(Se2)+c(H2Se) CO2e+H2O=CO2+2H+ 1.6×1012
【解析】
(1)根据盖斯定律求出反应的H;
(2)①该反应为气体的总物质的量不变的反应,根据反应达到平衡的判断依据作答;
②分离出的H2重新通入反应容器,会增大反应物中H2的浓度,据此分析对平衡的影响效果;
③结合已知图像分析作答;
(3)HSe 在溶液中存在电离平衡和水解平衡,根据已知条件求出HSe的水解平衡常数,进而比较出水解程度与电离程度的相对大小分析,再结合物料守恒作答;
(4)通入CO的Pt电极为原电池的负极,依据原电池原理书写其电极反应式;
(5)根据沉淀转化的化学平衡常数与各沉淀溶度积之间的关系进行计算。
(1)根据盖斯定律可知ΔH3 =![]() (ΔH2ΔH1)=
(ΔH2ΔH1)=![]() (ba)kJ·mol1,
(ba)kJ·mol1,
故答案为![]() (ba);
(ba);
(2)①由于反应前后气体的质量发生了变化,但气体的总物质的量不变,则
a. 建立平衡过程中气体质量增加,容器体积不变,气体密度增大,达到平衡时气体质量不变、气体密度不变,气体的密度不变能说明反应达到平衡状态;
b. υ(H2)= υ(H2Se)没有指明反应速率的方向,υ(H2)= υ(H2Se)不能作为达到平衡的判定依据;
c. 反应过程中在任何时刻压强都不改变,所以压强不变不能作为反应达到平衡的判定依据;
d. 建立平衡过程中气体质量增加,气体物质的量不变,气体的平均摩尔质量增大,达到平衡时气体质量不变,气体的平均摩尔质量不变,气体的平均摩尔质量不变能说明反应达到平衡状态;
故答案为ad;
②将平衡混合气通入气体液化分离器气体H2Se转化为液体H2Se,并将分离出的H2重新通入反应容器,会增大反应物中H2的浓度,平衡正向移动,Se的转化率提高,
故答案为将分离出的H2重新通入容器中,平衡正向移动,Se的转化率提高;
③由于最终是以5小时内得到的H2Se为产量指标,则从图1可知,在550℃时产率最高,所以最适宜的反应温度为550 ℃;由图2可知,反应5小时左右时,压强为0.3 Mpa条件下产率最高,因此最适宜压强为0.3 Mpa,
故答案为550℃,0.3 MPa;
(3)HSe 在溶液中存在电离平衡和水解平衡,HSe的水解平衡常数 = ![]() ≈7.7×1011>K2=5.0×1011,即HSe的水解能力大于其电离能力,则NaHSe溶液呈碱性,溶液中的物料守恒关系为c(Na+)=c(HSe)+c(Se2)+c(H2Se),
≈7.7×1011>K2=5.0×1011,即HSe的水解能力大于其电离能力,则NaHSe溶液呈碱性,溶液中的物料守恒关系为c(Na+)=c(HSe)+c(Se2)+c(H2Se),
故答案为碱性;c(Na+)=c(HSe)+c(Se2)+c(H2Se);
(4)根据题意,结合装置图,石墨极上Se得到电子发生还原反应生成H2Se,则石墨为正极,Pt为负极,在Pt电极上CO失电子发生氧化反应,电极反应式为CO2e+H2O=CO2+2H+,
故答案为CO2e+H2O=CO2+2H+;
(5)反应CuS(s)+Se2(aq)![]() CuSe(s)+S2(aq)的化学平衡常数K=
CuSe(s)+S2(aq)的化学平衡常数K=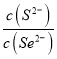 =
=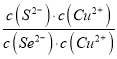 =
=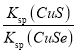 =
=![]() ≈1.6×1012,
≈1.6×1012,
故答案为1.6×1012。


科目:高中化学 来源: 题型:
【题目】碘在科研与生活中有重要应用。
(1)I2O5 是白色粉末状固体,在合成氨工业中常用 I2O5 来定量测量 CO 的含量。
已知:2I2 (s)+5O2 (g)=2I2O5 (s) △H=﹣75.56kJ·mol-1
2CO (g)+O2 (g)=2CO2 (g) △H=﹣566.0kJ·mol-1
写出 CO (g)与 I2O5 (s)反应析出固态 I2 的热化学方程式:_____,若这个反应一定能自发进行,则反应的△S_____0(填“>”,“<”或 “=”);
(2)某兴趣小组用 0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3 等试 剂,探究反应条件对化学反应速率的影响。
已知:Ⅰ、S2O82-+2I-=2SO42-+I2(慢) Ⅱ、I2+2S2O32-=2I- +S4O62-(快)
①向 KI、Na2S2O3 与淀粉的混合溶液中加入一定量的 K2S2O8 溶液,当溶液中的_____耗 尽后,溶液颜色将由无色变成为蓝色。 请从碰撞理论的角度解释上述产物未耗尽前溶液中看不到蓝色的原因:_____
②为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验 序号 | 体积 V/mL | ||||
K2S2O8 溶液 | 水 | KI 溶液 | Na2S2O3 溶液 | 淀粉溶液 | |
ⅰ | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
ⅱ | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
ⅲ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中 Vx=_____mL,理由是_____。
③已知某条件下,浓度 c (S2O82-)~反应时间 t 的变化曲线如图,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时 c (S2O82-)~t 的变化曲线示意图 _____(进行相应的标注)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A(g)![]() B(g)+D(g),在四种不同条件下进行,投入反应物A,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g),在四种不同条件下进行,投入反应物A,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:

根据上述数据,完成下列填空:
(1)在实验1,反应在20至30分钟时间内平均速率为_____mol/(L·min)。
(2)在实验2,反应经20分钟就达到平衡的原因可能是______。A的初始浓度C2______1.0mol/L(填>、=、<)。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3____V1(填>、=、<),且C3___1.0mol/L(填>、=、<)。
(4)从实验4可推测该反应是____反应(选填“吸热”“放热”)。理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成。
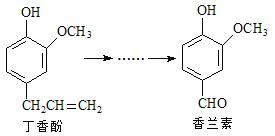
有关上述两种化合物的说法正确的是
A. 常温下,1mol丁香酚只能与1molBr2反应
B. 丁香酚不能使FeCl3溶液发生显色反应
C. 1mol香兰素最多能与3mol氢气发生加成反应
D. 香兰素分子中至少有12个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作会使最终结果偏高的是( )
A.配制![]() 溶液,定容时俯视刻度线
溶液,定容时俯视刻度线
B.用![]() 盐酸滴定
盐酸滴定![]() 溶液,起始读数时仰视
溶液,起始读数时仰视
C.用湿润的pH试纸测定![]() 溶液的pH
溶液的pH
D.测定中和热的数值时,将![]() 溶液倒入盐酸后,立即读数
溶液倒入盐酸后,立即读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的恒容密闭容器中发生反应xA(g)+yB(g) ![]() zC(g),图1表示200℃时容器中A、B、C物质的量随时间的变化,图2表示温度与C的体积分数的变化关系,则下列结论正确的是
zC(g),图1表示200℃时容器中A、B、C物质的量随时间的变化,图2表示温度与C的体积分数的变化关系,则下列结论正确的是
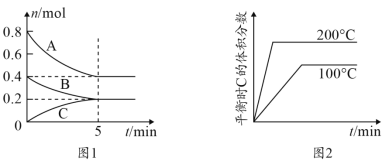
A.由图可知该反应为2A(g)+B(g) ![]() C(g) ΔH<0
C(g) ΔH<0
B.200℃,该反应的平衡常数为25
C.200℃时,反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
D.当外界条件由200℃降温到100℃,原平衡被破坏,且正逆反应速率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了日本吉野彰等三人,以表彰他们对锂离子电池研发的卓越贡献。
(1)自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷锂铝石等。为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈________,可以认为存在锂元素。
A.紫红色 B.紫色 C.黄色
(2)工业中利用锂辉石(主要成分为LiAlSi2O6,还含有FeO、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如下:
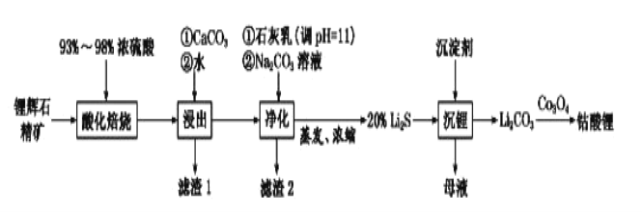
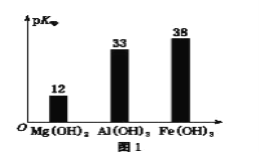
已知:部分金属氢氧化物的pKsp(pKsp=-lgKsp)的柱状图如图1。
回答下列问题:
①锂辉石的主要成分为LiAlSi2O6,其氧化物的形式为________。
②为提高“酸化焙烧”效率,常采取的措施是________。
③向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为_______。(保留到小数点后一位。已知:完全沉淀后离子浓度低于1×l0-5)mol/L)
④常温下,已知Ksp[ Mg(OH)2]=3.2×10-11mol/L,Ksp[Fe(OH)3]=2.7×10﹣39,若将足量的Mg(OH)2和Fe(OH)3分别投入水中均得到其相应的悬浊液,所得溶液中金属阳离子的浓度分别为____________mol/L、__________mol/L。
⑤“沉锂”过程所获得的“母液”中仍含有大量的Li+,可将其加入到“___________”步骤中。
⑥Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为__________
(3)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LiCoO2+C6 ![]() LixC6+Li1-xCoO2 ,其工作原理如图2。
LixC6+Li1-xCoO2 ,其工作原理如图2。
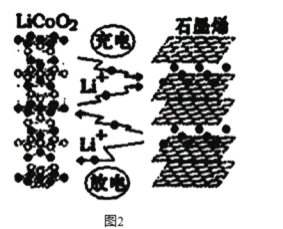
下列关于该电池的说法正确的是___________(填字母)。
A.电池反应式中过程1为放电过程
B.该电池若用隔膜可选用质子交换膜
C.石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
D.充电时,LiCoO2 极发生的电极反应为LiCoO2-xe-=xLi++Li1-xCoO2
E.对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)能自发进行,则△H<0
B.铁片镀锌时,铁片与外电源的正极相连
C.以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动
D.t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)![]() NO(g)+SO3(g),通入少量O2,
NO(g)+SO3(g),通入少量O2,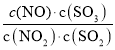 的值及SO2转化率不变
的值及SO2转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究课上,老师让同学们各自选题进行计算,其结果正确的是
A.甲同学:0.2 mol MgO,经计算,其质量为0.2 g
B.乙同学:9.03×1023个O2,经计算,O2物质的量为1.5 mol
C.丙同学:标准状况下,5.6 L 水的体积,经计算为 0.25 mol
D.丁同学:将30 mL0.5mol·L-1NaOH溶液加水稀释到500mL,经计算,稀释后溶液中NaOH的物质的量浓度为0.04mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com