
����Ŀ���̼��仯�����ڹ�ũҵ�����ͿƼ�������й㷺��Ӧ�á�
������Һ�е�Mn2+�ɱ����ԣ�NH4��2S2O8��Һ����ΪMnO4-���÷��������ڼ���Mn2+��
��1�������ԣ�NH4��2S2O8��Һ����Mn2+ʱ��ʵ������Ϊ________________________��
��2���÷�Ӧ�����ӷ���ʽΪ_____________________��
��3����NH4��2S2O8����Ϊ�������������������ã�������Ľṹ��ʽΪ ����H2S2O8�Ľṹ��ʽΪ ________________��
����H2S2O8�Ľṹ��ʽΪ ________________��
����ʵ�����ú��̷��ϣ���Ҫ�ɷ�ΪMnO2������������Al2O3��MgO��SiO2��Ϊԭ���Ʊ�Mn�Ĺ�����������ͼ��ʾ��

��֪����������������ܶȻ��������±���ʾ��
������ | Fe��OH��3 | Al��OH��3 | Mg��OH��2 | Mn��OH��2 |
�ܶȻ����� | 4.0��10-38 | 1.0��10-33 | 1.8��10-11 | 1.8��10-13 |
������Һ������Ũ����1.0��10-5mol L-1ʱ������Ϊ�����ӳ�����ȫ��
��1���������ʱ��MnO2��Fe����ΪFe3+���÷�Ӧ�����ӷ���ʽΪ________________________���ù����н���ʱ���Һ�̱ȶ��̽����ʵ�Ӱ��ֱ�����ͼ��ʾ��

�����˵Ľ���ʱ���Һ�̱ȷֱ�Ϊ____________��____________��
��2�������������������Һ��c��Mn2+��=0.18molL-1����Ӧ����pH���ķ�ΧΪ________________________��
��3�������ա���Ӧ���������뻹ԭ�������ʵ���֮��Ϊ__________������ԭ��ʱ�������û���Ӧ�ڻ�ѧ���ֽ���__________��
���𰸡���Һ����ɫ��Ϊ�Ϻ�ɫ 5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+ 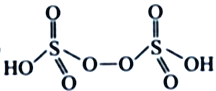 3MnO2+2Fe+12H+=3Mn2++2Fe3++6H2O 60min 3:1
3MnO2+2Fe+12H+=3Mn2++2Fe3++6H2O 60min 3:1 ![]() ��pH��8 1:2 ���ȷ�Ӧ
��pH��8 1:2 ���ȷ�Ӧ
��������
��.�������ȡ�У�ֻ��SiO2�������ᷴӦ����������SiO2�����ݺ�����������м����ΪMnCO3����Fe�����þ���Ϊ�˽��̵Ļ��ϼ۴�+4��ԭ��+2������1�л������˹��������ۡ�����pH���������Ӻ������ӣ�����NaF����þ���ӣ�����̼����麟����̣�����̼���̣��ڿ��������ձ���������ΪMnO2���������ȷ�Ӧ�õ��̵��ʡ�
��.��1����Һ�е�Mn2+ת��ΪMnO4-ʱ��ʵ������Ϊ��Һ����ɫ��Ϊ�Ϻ�ɫ����Ϊ��Һ����ɫ��Ϊ�Ϻ�ɫ��
��2��Mn2+�����ԣ�NH4��2S2O8��Һ����ΪMnO4-����ԭ����ӦΪSO42-����Ӧ�����ӷ���ʽΪ5S2O82-+2Mn2+ +8H2O==2MnO4-+10SO42-+16H+����Ϊ5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+��
��3��H2S2O8����Ϊ�������������������ã�����Ľṹ��ʽΪ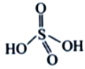 ����H2S2O8�Ľṹ��ʽΪ
����H2S2O8�Ľṹ��ʽΪ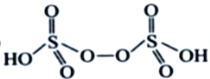 ����Ϊ
����Ϊ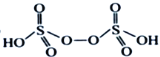 ��
��
��.��1����������Ϣ��֪���������ʱ��MnO2�����Խ����н�Fe����ΪFe3+����������ԭΪMn2+���÷�Ӧ�����ӷ���ʽΪ 3MnO2+2Fe+12H+=3Mn2++2Fe3++6H2O����ͼ��֪�����˵Ľ���ʱ��Ϊ60min����ͼ�ҿ�֪�����˵�Һͬ��Ϊ3:1����Ϊ3MnO2+2Fe+12H+=3Mn2++2Fe3++6H2O 60min 3:1��
��2��������ͼ����Ϣ֪������pH����Ŀ����ʹFe3+��A13+������ȫ����Mn2+������������Ksp[A1��OH��3]= 1.0��10-33��,Ksp[Fe��OH��3] = 4.0��10-38��֪��Al3+������ȫʱFe3+�ѳ�����ȫ��Al��OH��3ǡ����ȫ����ʱ��pHΪ-lg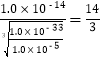 ��Mn2+��ʼ����ʱ��pHΪ-lg
��Mn2+��ʼ����ʱ��pHΪ-lg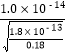 =8��������pH���ķ�ΧΪ
=8��������pH���ķ�ΧΪ![]() ��pH��8����Ϊ
��pH��8����Ϊ![]() ��pH��8��
��pH��8��
��3��������Ϣ֪����������ʱ�������е�O2��MnCO3�� ��ΪMnO2�����ݵ�ʧ�����غ�ɵù�ϵʽO2 2MnCO3�����������뻹ԭ�������ʵ���֮��Ϊ1:2������ԭ��ʱ������������۵����������ķ�Ӧ���ֳ����ȷ�Ӧ����Ϊ1:2 ���ȷ�Ӧ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������I��һ�ֿ���ȱѪҩ��ϳ�·�����£�

��֪��

�ش��������⣺
(1)������E�Ľṹ��ʽ____________________��I�й����ŵ�����_____________��
(2)A��ϵͳ����__________________________��
(3)H��I�ķ�Ӧ����ʽ______________________________��
(4)A��B��E��F�ķ�Ӧ���ͷֱ���______________��Ӧ��_____________��Ӧ��
(5)д��A�����Ӿ۷�Ӧ�ķ�Ӧ����ʽ___________________________________��
(6)G��ͬ���칹���ж��֣�д����������������G������ͬ���칹��Ľṹ��ʽ_________________��
����FeCl3��Һ������ɫ��Ӧ���ں˴Ź���������4���
(7)a,a-�����д�![]() �Ǻϳ�ҽҩ��ũҩ���м��壬�Ա���2-�ȱ���Ϊ��ʼԭ���Ʊ�a��a-�����д��ĺϳ�·�����£�
�Ǻϳ�ҽҩ��ũҩ���м��壬�Ա���2-�ȱ���Ϊ��ʼԭ���Ʊ�a��a-�����д��ĺϳ�·�����£�

��·�����Լ�������1Ϊ____________��X�Ľṹ��ʽΪ___________��Y�Ľṹ��ʽΪ____________���Լ�������2Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������̿�(��Ҫ�ɷ�ΪMnO2)�����̿�(��Ҫ�ɷ�ΪMnS)Ϊԭ���Ʊ������̾���Ĺ����������£�

(1)�����д���һ�ַǽ������ʣ�����������еĻ�ѧ����ʽΪ_________________________________��
(2)ʵ���ҳ���������ԭ���ⶨMnSO4��H2O����Ĵ��ȣ�ԭ�����£�2Mn2����NO3-��4PO43-��2H��===2[Mn(PO4)2]3����NO2-��H2O NH4+��NO2-===N2����2H2O [Mn(PO4)2]3����Fe2��===Mn2����[Fe(PO4)2]3������ȡMnSO4��H2O��Ʒ1.000 0 g����������ˮ������������λ���������������泥���220��240 ���³�ַ�Ӧ��Ȼ����N�������ڰ�����������ָʾ������0.100 0 mol��L��1��������隣���Һ�ζ����ɵ�[Mn(PO4)2]3�����յ㡣�ظ�����3�Σ���¼�������±���
�ζ����� | ��Һ����mL | |
�ζ�ǰ | �ζ��� | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
����֪��Fe2����NO2-��2H��===Fe3����NO����H2O��
�ⶨ�����У�����淋�������____________________��____________________��
�����ζ������б���Һ��������鱗��������õģ����ⶨ��MnSO4��H2O����Ĵ��Ƚ���________(����ƫ������ƫ��������������)��
�ۼ�����Ʒ��MnSO4��H2O����������(д���������)__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����������[��Ҫ�ɷ�Ϊ��������(FeTiO3)������MgO��SiO2 ������]Ϊԭ�ϣ��Ʊ������Ѻ�����Ĺ����������£���֪��������ʱ��FeTiO3ת��ΪFe2+��TiO2+���ڱ�ʵ���¶��£�Ksp[Mg(OH)2]= 1.0��10-11����ش��������⣺
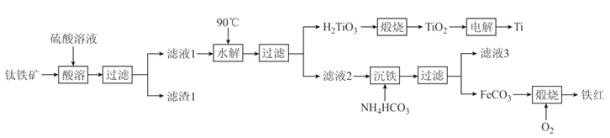
(1)FeTiO3��TiԪ�صĻ��ϼ�Ϊ_______�ۡ��������;Ϊ________________(��дһ��)��
(2)��ˮ�����У�������Ӧ�����ӷ���ʽΪ____________________________________________��
(3)���������У���̬����ĵ���ʽΪ_________���ù�������Ʒ�Ӧ�¶ȵ���35����ԭ��Ϊ_____________��
(4)FeCO3ת��Ϊ����ʱ��������Ӧ�Ļ�ѧ����ʽΪ________________________________________��
(5)��Һ3�������Ʊ�Mg(OH)2������Һ3 ��c(Mg2+)=1.2��10-4 mol��L-1�������м����Ũ�ȵ������NaOH��Һʱ��ͨ������˵������������______________________________(��Һ������Ƶ���)��
(6)���������ʱ��TiO2��ʯī���缫�������Ϊ���ڵ�CaO����������ӦʽΪ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ƿ�����ȵ����壬��ͬ�¡�ͬѹ��ƿ������Ĺ�ϵһ����ȷ����

A.ԭ�������
B.�ܶ����
C.�������
D.���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж������������ݵ���ؽ�����ȷ���ǣ� ��
ѡ�� | ���� | ���� |
A | ��ɰ��֮��ˮ���������ֻ��ɵ�ɰ | ������Ӧ��Ϊ���淴Ӧ |
B | ���������ߣ���ض����࣬��ȡ��ɳճ����Ϊ֮ | �������ߡ�����Ҫ�ɷ�Ϊ������ |
C | ��ʯ��KNO3��������ѩ������ǿ��֮���������� | �����������̡���ԭ��ΪKNO3�ֽ� |
D | �䷨��Ũ�ƾ��Ͳ���ƿ���������ϣ������е�¶ | �����漰�IJ�������Ϊ����Ũ�� |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ���������ʵ��װ����ͼ��ʾ���г�װ������ȥ����

����˵������ȷ���ǣ� ��
A. ˮԡ���ȵ��ŵ�Ϊʹ��Ӧ�����Ⱦ��ȡ��������¶�
B. ��Ũ���ᡢŨ����ͱ����ʱ��Ӧ��Ũ�����м���Ũ���ᣬ����ȴ�����º����û������뱽��
C. ʵ������з�������b��δ�������Ƭ������ȴ��
D. ��Ӧ��ȫ��������a��b����õ���Ʒ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�����Ϊ95 g���Ȼ�þ�ܽ���0.2 Lˮ����ˮ���ܶȽ���Ϊ1 g/mL��ǡ�õõ��Ȼ�þ�ı�����Һ��������Һ���ܶ�Ϊ�� g/mL�����ʵ���Ũ��Ϊc mol/L���ܽ��Ϊs��NA��ʾ�����ӵ�������ֵ����������������ȷ������������
A. ������Һ�к���NA���Ȼ�þ����
B. ������Һ�����ʵ���Ũ��Ϊ5 mol/L
C. ������Һ���ܽ�ȿɱ�ʾΪ9500 c/��1000��-95c��
D. ������Һ�����������ɱ�ʾΪ95 ��/��1000c��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ҩ��H��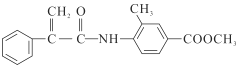 ����һ�ֿ���������������ҩ���ϳ�·����ͼ��ʾ��
����һ�ֿ���������������ҩ���ϳ�·����ͼ��ʾ��

��֪��
��1��E�ķ���ʽΪC9H8O2����ʹ������Ȼ�̼��Һ��ɫ��
��2��RCOOH![]()
![]() ��
��
��3��![]() +R1NH2
+R1NH2![]()
![]() +HBr��������R��R1��������
+HBr��������R��R1��������
��ش��������⣺
��1��A�Ľṹ��ʽΪ___________��E�Ĺ����ŵ�����Ϊ___________��
��2���ٵķ�Ӧ������________���ܵķ�Ӧ������__________��
��3��д��C��D�Ļ�ѧ����ʽ��______________________��
��4��д��F+G��H�Ļ�ѧ����ʽ��_________________________________________��
��5��E�ж���ͬ���칹�壬ͬʱ��������������E��ͬ���칹����____������˳���칹���֡�
i.�ܷ���������Ӧ��
ii.�ܷ���ˮ�ⷴӦ��
iii.�����к��Ļ�ֻ�б�����
��6������H�������ϳ�·�ߣ����һ������ȩ��NH2CH(CH3)2Ϊ��ʼԭ���Ʊ�ҽҩ�м���CH3CONHCH(CH3)2�ĺϳ�·��__________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com