
【题目】工业上以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含有MgO、SiO2 等杂质]为原料,制备金属钛和铁红的工艺流程如下:已知:①酸溶时,FeTiO3转化为Fe2+和TiO2+;②本实验温度下,Ksp[Mg(OH)2]= 1.0×10-11;请回答下列问题:
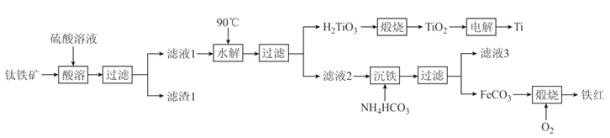
(1)FeTiO3中Ti元素的化合价为_______价。铁红的用途为________________(任写一种)。
(2)“水解”中,发生反应的离子方程式为____________________________________________。
(3)“沉铁”中,气态产物的电子式为_________;该过程需控制反应温度低于35℃,原因为_____________。
(4)FeCO3转化为铁红时,发生反应的化学方程式为________________________________________。
(5)滤液3可用于制备Mg(OH)2。若滤液3 中c(Mg2+)=1.2×10-4 mol·L-1,向其中加入等浓度等体积的NaOH溶液时,通过计算说明有无沉淀生成______________________________(溶液体积近似叠加)。
(6)电解生产钛时用TiO2和石墨做电极,电解质为熔融的CaO,则阴极反应式为__________________。
【答案】+4 制备红色颜料和油漆、冶炼铁等 TiO2++2H2O=H2TiO3↓+2H+[或TiO2++2H2O=TiO(OH)2+2H+] ![]() 防止NH4HCO3分解(或减少Fe2+的水解) 4FeCO3+O2=2Fe2O3+4CO2 Q=2.16×10-13< 1.0×10-11,故没有沉淀 TiO2+4e-=Ti+2O2-
防止NH4HCO3分解(或减少Fe2+的水解) 4FeCO3+O2=2Fe2O3+4CO2 Q=2.16×10-13< 1.0×10-11,故没有沉淀 TiO2+4e-=Ti+2O2-
【解析】
(1)FeTiO3中铁和氧的化合价分别为+2和-2,判断Ti元素的化合价;铁红的用途为制备红色颜料和油漆、冶炼铁等;
(2)酸溶时,FeTiO3转化为Fe2+和TiO2+;TiO2+水解生成H2TiO3沉淀,据此写出离子方程式;
(3) “沉铁”中,亚铁离子与碳酸氢根离子发生反应生成碳酸亚铁沉淀和二氧化碳;该过程需控制反应温度低于35℃,温度过高 NH4HCO3会分解,而且会促进亚铁离子的水解;
(4) FeCO3在氧气中加热生成氧化铁和二氧化碳,据此写出反应的化学方程式;
(5) 根据该反应的浓度商QC与 Ksp[Mg(OH)2]之间关系判断反应是否有沉淀生成;
(6)电解池中,TiO2在阴极发生还原反应生成钛,熔融的CaO为电解质,据此写出阴极反应。
(1)FeTiO3中铁和氧的化合价分别为+2和-2,所以Ti元素的化合价为+4价;铁红的用途为制备红色颜料和油漆、冶炼铁等;综上所述,本题答案是:+4; 制备红色颜料和油漆、冶炼铁等。
(2) 酸溶时,FeTiO3转化为Fe2+和TiO2+;TiO2+水解生成H2TiO3沉淀;离子方程式为:TiO2++2H2O=H2TiO3↓+2H+[或TiO2++2H2O=TiO(OH)2+2H+];综上所述,本题答案是:TiO2++2H2O=H2TiO3↓+2H+[或TiO2++2H2O=TiO(OH)2+2H+]。
(3) “沉铁”中,亚铁离子与碳酸氢根离子发生反应生成碳酸亚铁沉淀和二氧化碳,二氧化碳为共价化合物,电子式为:![]() ;该过程需控制反应温度低于35℃,温度过高 NH4HCO3会分解,而且会促进亚铁离子的水解,所以控制反应温度低于35℃是为了防止 NH4HCO3分解(或减少Fe2+的水解;综上所述。本题答案是:
;该过程需控制反应温度低于35℃,温度过高 NH4HCO3会分解,而且会促进亚铁离子的水解,所以控制反应温度低于35℃是为了防止 NH4HCO3分解(或减少Fe2+的水解;综上所述。本题答案是: ![]() ;防止NH4HCO3分解(或减少Fe2+的水解) 。
;防止NH4HCO3分解(或减少Fe2+的水解) 。
(4) FeCO3在氧气中加热生成氧化铁和二氧化碳,反应的化学方程式为:4FeCO3+O2=2Fe2O3+4CO2;综上所述,本题答案是:4FeCO3+O2=2Fe2O3+4CO2。
(5) 若滤液3中c(Mg2+)=1.2×10-4 mol·L-1,则NaOH溶液的浓度为1.2×10-4 mol·L-1,而溶液等体积混合,所以c(Mg2+)=c(OH-)=0.6×10-4 mol·L-1,该反应的浓度商QC= c(Mg2+)×c2(OH-)=2.16×10-13< Ksp[Mg(OH)2]= 1.0×10-11;所以没有沉淀生成;综上所述,本题答案是:Q=2.16×10-13< 1.0×10-11,故没有沉淀。
(6)电解池中,TiO2在阴极发生还原反应生成钛,熔融的CaO为电解质,阴极反应式为TiO2+4e-=Ti+2O2-;综上所述,本题答案是:TiO2+4e-=Ti+2O2-。


科目:高中化学 来源: 题型:
【题目】已知气态烃A在标准状况下的密度为1.25 g·L-1,C能够发生银镜反应, E与B、D均能发生酯化反应。有关物质的转化关系如下:

请回答:
(1) F的结构简式______。
(2) A→B的反应类型______。
(3) C→D的化学方程式______。
(4) 下列说法不正确的是______。
A.将金属钠投入B中,金属钠沉入底部,并缓慢的放出气泡
B.2 mol F可以反应产生1 mol环状化合物,其分子式为C4H6O5
C.G加入NaHCO3溶液中会产生气体
D.1 mol H可以与含2 mol NaOH的水溶液完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+)一定为10-7mol·L-l
B. 常温下pH =2的盐酸和pH =12的氨水等体积混合后生成NH4Cl,溶液显酸性
C. 常温下0.1 mol·L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)= 10-10 mol·L-l
D. 常温下向CH3COONa稀溶液中加入CH3COONa固体,c (CH3COO-)/c(Na+)比值变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-![]() H++A2-(Ka=1.0×10-2),下列说法正确的是( )
H++A2-(Ka=1.0×10-2),下列说法正确的是( )
A. 在0.1mol/L的Na2A溶液中,c(A2-)+c(HA-)+c(H2A)=0.1mol/L
B. 在0.1mol/L的H2A溶液中,c(H+)= 0.2 mol/L
C. 分别将浓度均为0.1mol/L的NaHA和Na2A溶液等体积混合,其pH一定大于7
D. 0.1mol/L的NaHA溶液中离子浓度为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为________。

(2)如图,装置进行NH3性质实验,A、B为体积相等的两个烧瓶。

①先打开旋塞1,B瓶中的现象是___________________________,稳定后,关闭旋塞1;
②再打开旋塞2,B瓶中的现象是___________________________。
(3)为了探究某一种因素对溶液中NH4Cl水解程度的影响,限制使用的试剂与仪器为固体NH4Cl,蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、PH计、温度计、恒温水浴槽(可控制温度),某同学拟定了如下实验表格:

①该同学的实验目的是探究_____________对溶液中NH4Cl水解程度的影响。
②按实验序号1所拟数据计算NH4Cl水解反应的平衡转化率为___________(只列出算式,忽略水自身电离的影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰及其化合物在工农业生产和科技领域具有广泛的应用。
Ⅰ.溶液中的Mn2+可被酸性(NH4)2S2O8溶液氧化为MnO4-,该方法可用于检验Mn2+。
(1)用酸性(NH4)2S2O8溶液检验Mn2+时的实验现象为________________________。
(2)该反应的离子方程式为_____________________。
(3)(NH4)2S2O8可视为由两分子琉酸缩合所得,若硫酸的结构简式为 ,则H2S2O8的结构简式为 ________________。
,则H2S2O8的结构简式为 ________________。
Ⅱ.实验室用含锰废料(主要成分为MnO2,还含有少量Al2O3、MgO、SiO2)为原料制备Mn的工艺流程如下图所示。

已知:①部分难溶物的溶度积常数如下表所示。
难溶物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
溶度积常数 | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
②当溶液中离子浓度≤1.0×10-5mol L-1时,可认为该离子沉淀完全。
(1)“酸浸”时,MnO2将Fe氧化为Fe3+,该反应的离子方程式为________________________;该过程中浸出时间和液固比对锰浸出率的影响分别如下图所示。

则适宜的浸出时间和液固比分别为____________、____________。
(2)若“酸浸”后所得滤液中c(Mn2+)=0.18molL-1,则应“调pH”的范围为________________________。
(3)“煅烧”反应中氧化剂与还原剂的物质的量之比为__________。“还原”时发生的置换反应在化学上又叫作__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HA的酸性弱于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1 molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的 物质的量浓度的负对数与溶液的pH的变化悄况如图所示。

下列说法正确的是( )
A. 曲线Ⅰ表示溶液的pH与-lgc(A-)的变化关系
B. ![]()
C. 溶液中水的电离程度:M>N
D. N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。向恒容密闭容器中充入0.1molCH4和0.2molH2S,不断升高温度,测得平衡时体系中各物质的物质的量分数与温度的关系如图所示:
CS2(g)+4H2(g)。向恒容密闭容器中充入0.1molCH4和0.2molH2S,不断升高温度,测得平衡时体系中各物质的物质的量分数与温度的关系如图所示:

下列说法正确的是
A. 该反应的△H<0
B. 维持Z点温度,向容器中再充入CH4、H2S、CS2、H2各0.1mol时,v(正)>v(逆)
C. X点与Y点容器内压强比为51:55
D. X点CH4的转化率为20%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com