
【题目】某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-![]() H++A2-(Ka=1.0×10-2),下列说法正确的是( )
H++A2-(Ka=1.0×10-2),下列说法正确的是( )
A. 在0.1mol/L的Na2A溶液中,c(A2-)+c(HA-)+c(H2A)=0.1mol/L
B. 在0.1mol/L的H2A溶液中,c(H+)= 0.2 mol/L
C. 分别将浓度均为0.1mol/L的NaHA和Na2A溶液等体积混合,其pH一定大于7
D. 0.1mol/L的NaHA溶液中离子浓度为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
【答案】D
【解析】
A、根据H2A 第一步完全电离和物料守恒解答;
B、二元酸H2A在水中的电离方程式为: H2A=H++HA-,HA-![]() H++A2-(Ka=1.0×10-2) ,第一步完全电离,第二步部分电离,根据平衡常数计算溶液的c(H+);
H++A2-(Ka=1.0×10-2) ,第一步完全电离,第二步部分电离,根据平衡常数计算溶液的c(H+);
C、HA-![]() H++A2-(Ka=1.0×10-2),电离平衡常数较大,同浓度0.1mol/L 的NaHA和Na2A溶液等体积混合,其pH应小于7;
H++A2-(Ka=1.0×10-2),电离平衡常数较大,同浓度0.1mol/L 的NaHA和Na2A溶液等体积混合,其pH应小于7;
D、0.1mol/L的NaHA溶液显酸性, c(HA-)>c(H+)。
A.二元酸H2A 在水中的电离方程式为: H2A=H++HA-,HA-![]() H++A2-(Ka=1.0×10-2),可以知道第一步完全电离,第二步部分电离,则在0.1mol/L 的Na2A溶液中,存在HA-和A2-离子,且c(A2-)+c(HA-) =0.1mol/L,A错误;
H++A2-(Ka=1.0×10-2),可以知道第一步完全电离,第二步部分电离,则在0.1mol/L 的Na2A溶液中,存在HA-和A2-离子,且c(A2-)+c(HA-) =0.1mol/L,A错误;
B. 在0.1mol/L的H2A溶液中,在水中的电离方程式为H2A=H++HA-,HA-![]() H++A2-(Ka=1.0×10-2),第一步完全电离,第二步部分电离,设电离的HA-为x,则有:(0.1+x)×x/(0.1-x)=1/100,解之得x=0.0084;所以在0.1mol/L的H2A 溶液中, c(H+)=0.1+0.0084=0.1084mol/L,故B错误;
H++A2-(Ka=1.0×10-2),第一步完全电离,第二步部分电离,设电离的HA-为x,则有:(0.1+x)×x/(0.1-x)=1/100,解之得x=0.0084;所以在0.1mol/L的H2A 溶液中, c(H+)=0.1+0.0084=0.1084mol/L,故B错误;
C.由Ka=1.0×10-2知, HA-的电离度为10%,在温度不变时,同浓度0.1mol/L 的NaHA和Na2A溶液等体积混合,溶液中的c(H+)近似为0.01mol/L,变化不大,溶液仍呈酸性,故C错误;
D. 0.1mol/L的NaHA溶液中,HA-的电离程度约为10%,溶液显酸性,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故D正确;
综上所述,本题选D。


科目:高中化学 来源: 题型:
【题目】高锰酸钾是中学常用化学试剂,工业上常以软锰矿(主要成分是MnO2)为原料进行制备,主要工艺流程如下图:
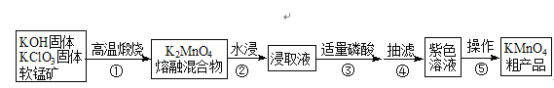
已知:3K2MnO4+2H3PO4═2KMnO4+MnO2↓+2K2HPO4+2H2O
物质 | KMnO4 | K2HPO4 | K2SO4 | CH3COOK | KCl | K2CO3 |
293K溶解度/g | 6.4 | 150 | 11.1 | 217 | 34 | 111 |
(1)原料高温煅烧时选用铁坩埚和铁棒,理由是__________。
(2)①中每生成1molK2MnO4时电子转移2mol,写出化学反应方程式_________。
(3)从反应机理和产物分离角度考虑,③可用磷酸,也可用下列________试剂。
A.醋酸 B.盐酸 C.硫酸 D.CO2
(4)下列描述不正确的是_________。
A.操作⑤中蒸发至大量晶体析出再冷却晶体,趁热过滤
B.抽滤时布氏漏斗中选用大小略小于漏斗内径且盖住全部小孔的滤纸
C.可用无水乙醇洗涤产品提高纯度
D.KMnO4晶体的烘干温度过高会降低产率
(5)粗产品的洗涤步骤可能需要用到以下操作:a.加入洗涤剂至浸没固体;b.洗涤剂缓慢通过;c.洗涤剂快速通过;d.关小水龙头;e.开大水龙头;f.重复2~3次。
请选出正确的操作并排序________。(操作可重复使用)
(6)高锰酸钾产品的纯度测定:准确称取0.7900g产品,配成250mL溶液,量取25.00mL于锥形瓶中,用0.1000molL﹣1(NH4)2Fe(SO4)2标准溶液进行滴定,滴定终点的现象__________。滴定前和滴定后的液面见下图。计算出高锰酸钾的纯度为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达到平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A. 升高温度,正反应速率增大,逆反应速率减小
B. 该反应的化学方程式为CO+H2O![]() CO2+H2
CO2+H2
C. 恒温恒容下,增大压强,H2浓度一定减小
D. 该反应的焓变为正值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料制备硫酸锰晶体的工艺流程如下:

(1)滤渣中存在一种非金属单质,则酸浸过程中的化学方程式为_________________________________。
(2)实验室常用氧化还原法测定MnSO4·H2O晶体的纯度,原理如下:2Mn2++NO3-+4PO43-+2H+===2[Mn(PO4)2]3-+NO2-+H2O NH4++NO2-===N2↑+2H2O [Mn(PO4)2]3-+Fe2+===Mn2++[Fe(PO4)2]3-;称取MnSO4·H2O样品1.000 0 g,溶于适量水,以磷酸作配位剂,加入过量硝酸铵,在220~240 ℃下充分反应。然后以N—苯代邻氨基苯甲酸作指示剂,用0.100 0 mol·L-1硫酸亚铁铵标准溶液滴定生成的[Mn(PO4)2]3-至终点。重复操作3次,记录数据如下表:
滴定次数 | 标准液读数mL | |
滴定前 | 滴定后 | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
①已知:Fe2++NO2-+2H+===Fe3++NO↑+H2O。
测定过程中,硝酸铵的作用是____________________和____________________。
②若滴定过程中标准溶液硫酸亚铁铵不是新配置的,所测定的MnSO4·H2O晶体的纯度将会________(填“偏高”“偏低”或“不变”)。
③计算样品中MnSO4·H2O的质量分数(写出计算过程)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-空气电池是一种新型的二次电池,其放电时的工作原理如图所示,下列说法正确的是

A. 该电池放电时,正极的反应式为O2+4e-+4H+=2H2O
B. 该电池充电时,阴极发生了氧化反应:Li++e-=Li
C. 电池中的有机电解液可以用稀盐酸代替
D. 充电时,空气极与直流电源正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含有MgO、SiO2 等杂质]为原料,制备金属钛和铁红的工艺流程如下:已知:①酸溶时,FeTiO3转化为Fe2+和TiO2+;②本实验温度下,Ksp[Mg(OH)2]= 1.0×10-11;请回答下列问题:
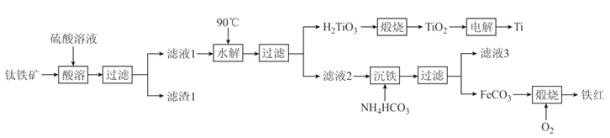
(1)FeTiO3中Ti元素的化合价为_______价。铁红的用途为________________(任写一种)。
(2)“水解”中,发生反应的离子方程式为____________________________________________。
(3)“沉铁”中,气态产物的电子式为_________;该过程需控制反应温度低于35℃,原因为_____________。
(4)FeCO3转化为铁红时,发生反应的化学方程式为________________________________________。
(5)滤液3可用于制备Mg(OH)2。若滤液3 中c(Mg2+)=1.2×10-4 mol·L-1,向其中加入等浓度等体积的NaOH溶液时,通过计算说明有无沉淀生成______________________________(溶液体积近似叠加)。
(6)电解生产钛时用TiO2和石墨做电极,电解质为熔融的CaO,则阴极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。

下列说法不正确的是( )
A. 水浴加热的优点为使反应物受热均匀、容易控制温度
B. 将浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加人浓硫酸,待冷却至室温后,将所得混合物加入苯中
C. 实验过程中发现仪器b中未加入碎瓷片,可冷却后补加
D. 反应完全后,可用仪器a、b蒸馏得到产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想已成为现实。某化学兴趣小组在实验室中模拟上述过程(反应缓慢不发生爆炸),其设计的模拟装置如下:

根据要求填空:
(1)仪器F的名称______________;A中反应的离子反应方程式___________________。
(2)B装置有三种功能:①控制气流速度;②均匀混合气体③______________________。
(3)为了除多余的氯气,D装置中的石棉网均匀附着KI粉末,你认为能否换成碱石灰______(填“能”或“不能”)。
(4)E装置的作用________。
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(5)E装置中除了盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法:_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com