
【题目】实验室制取乙酸丁酯,图装置中正确的是
A.  B.
B.  C.
C.  D.
D. 
【答案】B
【解析】
乙酸丁酯的沸点124~126℃,反应温度115~125℃
A、该装置采用长导管可起冷凝作用,但采用水浴,反应温度不超过100℃;
B、有机物易挥发,长玻璃管可起冷凝作用。
C、反应温度115~125℃,不用水浴加热;
D、反应温度115~125℃,不用水浴加热;
A、该装置采用长导管可起冷凝易挥发的乙酸和丁醇,但采用水浴,反应温度不超过100℃,实验室制取乙酸丁酯,反应需要反应温度为115~125℃,而水浴加热适合温度低于100℃的反应,故A错误;
B、实验室制取乙酸丁酯,原料乙酸和丁醇易挥发,当有易挥发的液体反应物时,为了避免反应物损耗和充分利用原料,要在发生装置设计冷凝回流装置,使该末反应的物质通过冷凝后由气态恢复为液态,从而回流并收集,提高反应原料的利用率。实验室可通过在发生装置安装长玻璃管或冷凝回流管等实现,该装置符合这些要求,故B正确;
C、反应温度115~125℃,不用水浴加热,故C错误;
D、反应温度115~125℃,不用水浴加热,故D错误;
故选B。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】某同学为探究浅黄色液体X(仅含三种常见元素)的组成和性质,设计并完成如下实验:
 请回答如下问题:
请回答如下问题:
(1)X的化学式是_________。
(2)X在过量氧气中燃烧的化学方程式是_________。
(3)溶液C滴在淀粉KI试纸上,试纸显蓝色,写出该变化中发生的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I是一种抗脑缺血药物,合成路线如下:

已知:

回答下列问题:
(1)化合物E的结构简式____________________;I中官能团的名称_____________。
(2)A的系统名称__________________________;
(3)H→I的反应方程式______________________________。
(4)A→B、E→F的反应类型分别是______________反应;_____________反应。
(5)写出A发生加聚反应的反应方程式___________________________________。
(6)G的同分异构体有多种,写出符合下列条件的G的所有同分异构体的结构简式_________________。
①遇FeCl3溶液发生显色反应;②核磁共振氢谱有4组峰
(7)a,a-二甲基苄醇![]() 是合成医药、农药的中间体,以苯和2-氯丙烷为起始原料制备a,a-二甲基苄醇的合成路线如下:
是合成医药、农药的中间体,以苯和2-氯丙烷为起始原料制备a,a-二甲基苄醇的合成路线如下:

该路线中试剂与条件1为____________;X的结构简式为___________,Y的结构简式为____________;试剂与条件2为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同的条件下进行合成氨反应,N2 (g)+3H2 (g)![]() 2NH3(g),根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )
2NH3(g),根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )
A. v(NH3)=0.1mol/(L·min) B. v(NH3)=0.2mol/(L·min)
C. v(N2)=0.3mol/(L·min) D. v(H2)=0.4mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达到平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A. 升高温度,正反应速率增大,逆反应速率减小
B. 该反应的化学方程式为CO+H2O![]() CO2+H2
CO2+H2
C. 恒温恒容下,增大压强,H2浓度一定减小
D. 该反应的焓变为正值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的CH4、H2、O2、N2四种气体,体积最大的是____,(填化学式,下同),分子数最多的是____,密度最大的是____,原子数最多的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料制备硫酸锰晶体的工艺流程如下:

(1)滤渣中存在一种非金属单质,则酸浸过程中的化学方程式为_________________________________。
(2)实验室常用氧化还原法测定MnSO4·H2O晶体的纯度,原理如下:2Mn2++NO3-+4PO43-+2H+===2[Mn(PO4)2]3-+NO2-+H2O NH4++NO2-===N2↑+2H2O [Mn(PO4)2]3-+Fe2+===Mn2++[Fe(PO4)2]3-;称取MnSO4·H2O样品1.000 0 g,溶于适量水,以磷酸作配位剂,加入过量硝酸铵,在220~240 ℃下充分反应。然后以N—苯代邻氨基苯甲酸作指示剂,用0.100 0 mol·L-1硫酸亚铁铵标准溶液滴定生成的[Mn(PO4)2]3-至终点。重复操作3次,记录数据如下表:
滴定次数 | 标准液读数mL | |
滴定前 | 滴定后 | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
①已知:Fe2++NO2-+2H+===Fe3++NO↑+H2O。
测定过程中,硝酸铵的作用是____________________和____________________。
②若滴定过程中标准溶液硫酸亚铁铵不是新配置的,所测定的MnSO4·H2O晶体的纯度将会________(填“偏高”“偏低”或“不变”)。
③计算样品中MnSO4·H2O的质量分数(写出计算过程)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含有MgO、SiO2 等杂质]为原料,制备金属钛和铁红的工艺流程如下:已知:①酸溶时,FeTiO3转化为Fe2+和TiO2+;②本实验温度下,Ksp[Mg(OH)2]= 1.0×10-11;请回答下列问题:
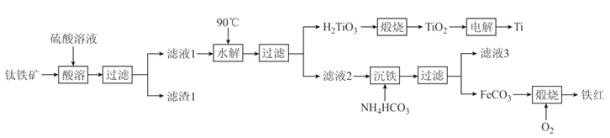
(1)FeTiO3中Ti元素的化合价为_______价。铁红的用途为________________(任写一种)。
(2)“水解”中,发生反应的离子方程式为____________________________________________。
(3)“沉铁”中,气态产物的电子式为_________;该过程需控制反应温度低于35℃,原因为_____________。
(4)FeCO3转化为铁红时,发生反应的化学方程式为________________________________________。
(5)滤液3可用于制备Mg(OH)2。若滤液3 中c(Mg2+)=1.2×10-4 mol·L-1,向其中加入等浓度等体积的NaOH溶液时,通过计算说明有无沉淀生成______________________________(溶液体积近似叠加)。
(6)电解生产钛时用TiO2和石墨做电极,电解质为熔融的CaO,则阴极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,质量为95 g的氯化镁溶解在0.2 L水中(水的密度近似为1 g/mL)恰好得到氯化镁的饱和溶液,所得溶液的密度为ρ g/mL,物质的量浓度为c mol/L,溶解度为s,NA表示阿伏加德罗常数的值,则下列叙述中正确的是( )
A. 所得溶液中含有NA个氯化镁分子
B. 所得溶液的物质的量浓度为5 mol/L
C. 所得溶液的溶解度可表示为9500 c/(1000ρ-95c)
D. 所得溶液的质量分数可表示为95 ρ/(1000c)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com