
【题目】当溶液中X2O72-和SO32-的离子数之比为1:3时正好完全发生氧化还原反应,X在还原产物中的化合价为
A. +1 B. +2 C. +3 D. +4
科目:高中化学 来源: 题型:
【题目】现用质量分数为98%、密度为1.84gcm﹣3的浓H2SO4来配制500mL0.25mol/L的稀H2SO4 . 可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒⑥容量瓶 ⑦托盘天平 ⑧药匙.请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有(填代号).
(2)经计算,需浓H2SO4的体积为 . 现有①10mL ②50mL ③100mL三种规格的量筒,应选用的量筒是(填代号).
(3)将浓H2SO4加适量蒸馏水稀释,冷却片刻,随后全部转移到mL的容量瓶中,转移时应用玻璃棒 . 转移完毕,用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀.然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度1~2cm处.改用加蒸馏水到瓶颈刻度的地方,使溶液的凹液面正好与刻度线相切.振荡、摇匀后,装瓶、贴签.
(4)在配制过程中,其他操作都准确,下列操作中:能引起误差偏高的有(填代号).①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A. 自然界中硫是一种淡黄色难溶于水的固体
B. 硫的化合物常存在于火山喷出的气体中和矿泉水里
C. 硫与金属反应,生成金属的低价态化合物
D. 硫在空气中的燃烧产物是二氧化硫,纯氧中的燃烧产物是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连.请回答以下问题: 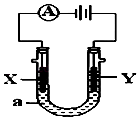
(1)若X,Y都是惰性电极,a是NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①Y电极上的电极反应式为 . 在X极附近观察到的现象是:
检验Y电极产物的方法是:
②电解总反应离子方程式为 .
(2)若X和Y仍均为惰性电极,a为CuSO 4 溶液,则电解时的化学反应方程式为
. 通过一段时间后,向所得溶液中加入16g CuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为 .
(3)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是
②Y电极的电极反应式是(说明:杂质发生的电极反应不必写出)
③假若电路中有0.04摩尔电子通过时,阴极增重克.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油通过裂解可以得到乙烯,乙烯的产量可以用来衡量一个国家石油化工发展水平.如图是由乙烯为原料生产某些化工产品的转化关系图. 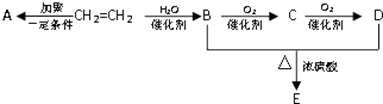
(1)乙烯生成B的反应类型是 .
(2)A的名称是 .
(3)C中含有的官能团是(填名称).
(4)写出B+D→E的化学反应方程式: .
(5)写出与E同类的任意两种同分异构体的结构简式、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:2SO2(g)+O2 (g)═2SO3(g),其正反应放热.现有三个体积相同的密闭容器 I、Ⅱ、Ⅲ,按如图所示投料,并在400℃条件下开始反应.达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅲ中平衡常数相同
B.容器Ⅱ、Ⅲ中正反应速率相同
C.容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:Ⅱ>Ⅲ
D.容器Ⅰ中SO2的转化率与容器 II中SO3的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向浓度相等、体积均为50mL的A、B两份NaOH溶液中,别通入一定量的CO2后,再稀释到100mL.在稀释后的溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如下图所示: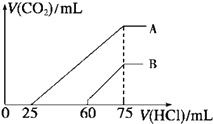
①A曲线表明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2的最大体积是mL(标准状况);
②B曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为物质的量之比为;
③原NaOH溶液的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、已知:常温下,A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为醋酸,且a=4,那么A溶液中水电离出的氢离子浓度为________mol/ L。
(2)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显酸性。则混合溶液中必定有一种离子能发生水解, 该离子为______________(填离子符号);
混合后的溶液中,下列微粒浓度大小关系一定正确的是___________(填序号)。
①c(MOH)>c(M+)>(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+) >c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-)
Ⅱ.难溶电解质的溶解平衡属于化学平衡的一种。
(1)已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-。常温下CaA的饱和溶液中存在以下平衡:CaA(s)
H++A2-。常温下CaA的饱和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0,则该饱和溶液呈_______性(填“酸”、“碱”或“中”),将溶液放入冰水浴中,则CaA的Ksp将________(填“增大”、“减小”或“不变”)。
Ca2+(aq)+A2-(aq) ΔH>0,则该饱和溶液呈_______性(填“酸”、“碱”或“中”),将溶液放入冰水浴中,则CaA的Ksp将________(填“增大”、“减小”或“不变”)。
(2)含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-。为使废水能达标排放,做如下处理:先加入FeSO4·7H2O与Cr2O72-反应生成Cr3+、Fe3+,然后调节pH,使之生成Cr(OH)3、Fe(OH)3。欲使10 L该废水中的Cr2O72-完全转化为Cr3+,则理论上需要加入_________g FeSO4·7H2O。若处理后的废水中残留的c(Fe3+)=2×10-13 mol·L-1,则残留的Cr3+的浓度为_________mol·L-1(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室中制备气体或验证气体性质的装置图.
(1)仪器a的名称是 .
(2)利用上图装置制备纯净、干燥的氯气.①圆底烧瓶内发生反应的离子方程式为 .
②装置C中的溶液为;B溶液的作用为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com