
����Ŀ����֪A��B��CΪ���ֳ����ĵ��ʣ��ܷ�����ͼ1��ʾ��ת����ϵ��B��һ��ͬ��������ľ�����ͼ2��ʾ��

�ش��������⣺
��1���γ�A��Ԫ�������ڱ��е�λ����__________________________________��A��Ӧ�Ļ�̬ԭ�ӵļ۵����Ų�Ϊ_____________________��
��2����B���ʶ�Ӧ�Ļ�̬ԭ���У��������___________�����������෴�ĵ��ӡ�
��3��д��Y��һ�ֳ����ȵ�������ӵĽṹʽ__________________________��������ȽϷе�ϸߵ���__________���ѧʽ����Y������B��Ӧԭ�ӵ��ӻ���ʽΪ_________________��
��4�������A(Y)x�����³�Һ̬���۵�Ϊ-20.5�棬�е�Ϊ103�棬�����ڷǼ����ܼ����ݴ˿��ж�A(Y)x��������________________��������ͣ���A(Y)x������ԭ�Ӽ۵������������ṩ�ĵ�����֮��Ϊ18����x=__________��A(Y)x��һ�������·�����ӦA(Y)x (s) ![]() A (s) + x Y (g)����֪��Ӧ������ֻ������λ�����ɴ��жϸ÷�Ӧ���γɵĻ�ѧ��������_____________��
A (s) + x Y (g)����֪��Ӧ������ֻ������λ�����ɴ��жϸ÷�Ӧ���γɵĻ�ѧ��������_____________��
��5����ͼ2�����У�ÿ������ƽ��ռ��__________��ԭ�ӣ����������������ԭ�ӵľ���ΪL cm�������߳�Ϊa cm������Ӳ��Ӵ�ģ�ͣ���L=_________a���������ܶ���=___________g��cm-3���ú�a��NA����ʽ��ʾ����
���𰸡� �������ڵڢ��� 3d64s2 2 N��N CO sp ���Ӿ��� 5 ������ 8 ![]()
![]()
��������A��B��CΪ���ֳ����ĵ��ʣ���ˮ�����ڸ����·�Ӧ���ɵ���C����CΪ������A��B�ֱ�Ϊ����̼��B����ͬ�������壬��BΪ̼����AΪ�������XΪ������������YΪһ����̼��DΪ������̼��
(1)��Ԫ��Ϊ26��Ԫ�أ������ڱ��е�λ��Ϊ�������ڵ�VIII����A��Ӧ�Ļ�̬ԭ�ӵļ۵����Ų�Ϊ3d64s2���ʴ�Ϊ���������ڵ�VIII����3d64s2��
(2)C�Ļ�̬ԭ�ӵĵ����Ų�Ϊ1s22s22p2���������2�����������෴�ĵ��ӣ��ʴ�Ϊ��2��
(3)CO��һ�ֳ����ȵ��������Ϊ�������ṹʽΪN��N��COΪ���Է��ӣ�������ȽϷе�ϸߣ�CO������C��2��ԭ��������û�йµ��Ӷԣ�����sp�ӻ����ʴ�Ϊ��N��N��CO��sp��
(4)�����Fe(CO)x�����³�Һ̬���۵�Ϊ-20.5�棬�е�Ϊ103�棬�����ڷǼ����ܼ���Fe(CO)x���ڷ��Ӿ��塣��ԭ�ӵļ۵�����Ϊ8��Fe(CO)x������ԭ�Ӽ۵������������ṩ�ĵ�����֮��Ϊ18�����γɵ���λ��Ϊx=![]() =5��Fe(CO)5��һ�������·�����ӦFe(CO)5 (s)
=5��Fe(CO)5��һ�������·�����ӦFe(CO)5 (s) ![]() Fe(s) + 5CO (g)����֪��Ӧ������ֻ������λ�����ɴ��жϸ÷�Ӧ�γ������еĽ��������ʴ�Ϊ�����Ӿ��壻5����������
Fe(s) + 5CO (g)����֪��Ӧ������ֻ������λ�����ɴ��жϸ÷�Ӧ�γ������еĽ��������ʴ�Ϊ�����Ӿ��壻5����������
(5)���ݾ����ṹ��ÿ������ƽ��ռ�е�ԭ����=8��![]() +6��
+6��![]() +4=8�����������������ԭ�ӵľ���Ϊ��Խ��߳��ȵ�
+4=8�����������������ԭ�ӵľ���Ϊ��Խ��߳��ȵ�![]() ����
����![]() acm=L cm�����������Ϊa3cm3������������Ϊ
acm=L cm�����������Ϊa3cm3������������Ϊ![]() g���������ܶ���=
g���������ܶ���=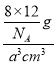 =
=![]() g��cm-3���ʴ�Ϊ��8��
g��cm-3���ʴ�Ϊ��8�� ![]() ��
�� ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.һ���¶�����2L���ܱ������ڷ�����Ӧ��H2(g)+I2(g)![]() 2HI(g)����ʼʱͨ��0.8molH2��һ������I2(g)�������ʵ�Ũ����ʱ��ı仯�����ͼ��ʾ������I2(g)��Ũ�ȱ仯����ǰ�벿������ȥ��
2HI(g)����ʼʱͨ��0.8molH2��һ������I2(g)�������ʵ�Ũ����ʱ��ı仯�����ͼ��ʾ������I2(g)��Ũ�ȱ仯����ǰ�벿������ȥ��

��ش��������⣺
(1)�Ƚ�����Ӧ����(ͬһ����)�Ĵ�С��A��_____(��������ܡ���=��)B�㡣
(2)�ӷ�Ӧ��ʼ���ﵽƽ�⣬HI��ƽ����Ӧ����Ϊ________��
(3)��ʼʱI2�����ʵ���Ϊ______mol��
II.��ͼ��ú�ۺ����õ�һ�ּ����̡���֪��A������������ܶ���14��CΪ��������ζ����E��һ����ˮ����ζ����Һ�塣

(1)�л���D�к��еĹ����ŵ�������___________��
(2)�١����������ڼӳɷ�Ӧ����_______(�����)��
(3)д���۵ķ�Ӧ����ʽ____________��
(4)����˵����ȷ����____(����ĸ)��
a.�ڢٲ���ú��Һ����Ϊú���ۺ����õ�һ�ַ���
b.�л���C��D������������Ʒ�����Ӧ
c.�л���C��D��ˮ��Һ������ɱ����������
d.�л���E���л���D�����ķ��룬����������������Һ����Һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йؾ���Ľṹ����ͼ��ʾ������˵���в���ȷ���ǣ�������
A.
��NaCl�����У���Na+�����Cl���γ���������
B.
��CaF2�����У�ÿ������ƽ��ռ��4��Ca2+
C.
�ڽ��ʯ�����У�̼ԭ����̼̼�������ı�Ϊ1��4
D.
ͭ����Ϊ���������ѻ���ͭԭ�ӵ���λ��Ϊ12
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ⱥ����ܱ�������ͨ��SO2��NO2����һ��������ʹ��ӦSO2(g)��NO2(g)![]() SO3(g)��NO(g) �ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ������ʾ����ͼ�ɵó�����ȷ������
SO3(g)��NO(g) �ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ������ʾ����ͼ�ɵó�����ȷ������
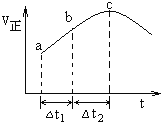
A. ��Ӧ��c��ﵽƽ��״̬
B. ��t1=��t2ʱ��SO2��ת���ʣ�a~b��С��b~c��
C. ��Ӧ��Ũ�ȣ�a��С��b��
D. ��Ӧ��������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25�桢101kPa �£�
��2Na��s��+ ![]() O2��g���TNa2O��s����H1=��414KJ/mol
O2��g���TNa2O��s����H1=��414KJ/mol
��2Na��s��+O2��g���TNa2O2��s����H2=��511KJ/mol
����˵����ȷ���ǣ�������
A.�ٺ͢ڲ�����������Ӹ����Ȳ����
B.�ٺ͢����ɵ����ʵ����IJ��ת�Ƶ�������ͬ
C.������Na������O2��Ӧ����Na2O�����¶���������Na2O�������ӿ�
D.25�桢101kPa �£�Na2O2��s��+2 Na��s���T2Na2O��s����H=��317kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.25mol Na2SO4��������Na+���Ӹ���ԼΪ ( )
A.3.01��1023B.6.02��1023C.0.5 molD.1 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǿ��淴ӦA+2B![]() 2C+3D�Ļ�ѧ��Ӧ�����뻯ѧƽ������������ı䣨�Ƚ��º��ѹ�����仯��������ɴ��ƶϴ������
2C+3D�Ļ�ѧ��Ӧ�����뻯ѧƽ������������ı䣨�Ƚ��º��ѹ�����仯��������ɴ��ƶϴ������

A. ����Ӧ�Ƿ��ȷ�Ӧ
B. A��Bһ����������
C. Dһ����������
D. C����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϴӺ���Cr2O72����Cr3+�ķ�ˮ�л��ո��Ĺ���������ͼ��ʾ��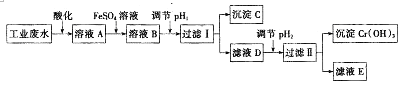
��֪����2CrO42������ɫ��+2H+Cr2O72������ɫ��+H2O��
�ڳ����£�Ksp[��Fe��OH��3]=4.0��10��38��Ksp[��Cr��OH��3]=1.0��10��32
�۵�����Ũ��С��1.0��10��5molL��1ʱ����Ϊ������ȫ
��ش��������⣺
��1���ữ�����ҺA��ɫ��
��2������FeSO4��Һʱ�����˼�ˮ���Ҫ������Լ��������Լ����ƣ���
��3������ҺA�м���FeSO4��Һ������Ӧ�����ӷ���ʽΪ ��
��4������C�Ļ�ѧʽΪ �� ҪʹCr3+������ȫpH2ֵ����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ��ԭ�ӵ�ԭ�Ӻ������������Ӳ㣬K�������Ϊa��L�������Ϊb��M�������Ϊb��a����ԭ�Ӻ��ڵ���������(
A. 14 B. 15 C. 16 D. 17
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com