
 MgxMo3S4,下列说法错误的是( )
MgxMo3S4,下列说法错误的是( )| A.放电时Mg2+向正极迁移 |
| B.放电时正极反应为Mo3S4+2xe-=Mo3S42x- |
| C.充电时Mo3S4发生氧化反应 |
| D.充电时阴极反应为Mg2++2e-=Mg |
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源:不详 题型:单选题

| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 |
| D.产生气泡的速率甲比乙慢 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.微热 |
| B.加入适量氧化铜 |
| C.加入少量硫酸铜溶液 |
| D.加水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
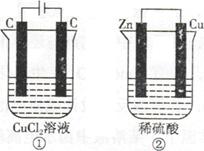
| A.产生气体的体积:①>② |
| B.溶液的pH变化:①减小,②增大 |
| C.电极上生成物质的质量:①=② |
| D.电极反应式:①中阳极2Cl—-2e—=Cl2↑,②中负极2H++2e—=H2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
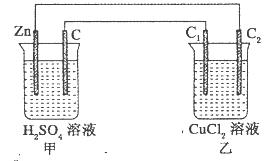
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是( )
的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是( )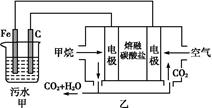
| A.燃料电池中若有1.6 g CH4参加反应,则甲中C电极理论上生成气体体积为8.96 L |
| B.实验时若污水中离子浓度较小,导电能力较差,可加入适量的Na2SO4 |
C.该燃料电池正极的电极反应式为:O2+4e-+2CO2=2C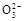 |
D.甲中阳极附近溶液中的离子反应方程式是:Cr2 +6Fe2++14H+=2Cr3++6Fe3++7H2O +6Fe2++14H+=2Cr3++6Fe3++7H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
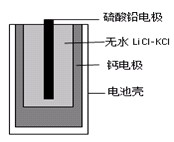
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
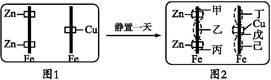
| A.甲区呈现蓝色 | B.乙区呈现红色 |
| C.戊区产生Cu2+离子 | D.丁区产生Fe3+离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com