
【题目】元素周期表是一座开放的“元素大厦”,”元素大厦”尚未客满。若发现120号元素,请在“元素大厦”中安排好它的“房间”
A.第七周期0族B.第七周期第IIA族C.第八周期第IIA族D.第八周期第IA族
科目:高中化学 来源: 题型:
【题目】氢氧化钡是分析化学中的重要试剂。工业上以重晶石矿(主要成分BaSO4,含杂质Fe2O3、SiO2)为原料,生产Ba(OH)2·8H2O的流程示意如下:

已知:高温焙烧,炭还原重晶石的反应方程式为:BaSO4+4C![]() CO↑+BaS
CO↑+BaS
(1)氢氧化钡的电子式为___________。
(2)水浸并过滤后的滤渣中含三种单质,分别为C、______和____ (填化学式),滤液1显______(填“酸性”或“碱性”)。向滤液1中加入CuO后,会生成黑色沉淀,该反应的化学方程式为___________。
(3)还可采用如下流程对滤液1进行处理:

若D物质为AB型,其组成与MnO2相同,滤液1中加入MnO2的化学方程式为_______。该方法的优点是_____。
(4)由滤液2得到产品需采用的操作是___________、___________、过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又可作为燃料。利用CO2和H2在催化剂的作用下合成甲醇,主要发生的反应如下:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) H1=-53.7 kJmol-1
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g) H2=+41.2 kJmol-1
(1)已知化学键的键能如下:

①反应Ⅲ:CO(g)+ 2H2(g) CH3OH(g) H3=_____________。
②碳氧双键的键能为__________________。
③在某一条件下,上述反应同时发生,若反应I、Ⅱ、III的化学平衡常数分别为K1、K2、K3,则K2=____________________(用含K1、K3的形式表示)。
(2)研究表明,在催化剂存在下,CO2和H2可发生反应I和Ⅱ。某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据(甲醇选择性即转化的CO2中生成甲醇的百分数):
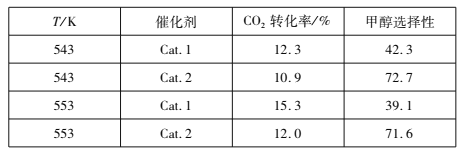
①543 K时,使用催化剂Cat.2,测得实验数据时反应I所处的状态为________________(填:“正向进行”、“平衡状态”、“逆向进行”)。
②有利于提高反应I中H2平衡转化率的措施是___________(填标号)。
A.使用催化剂Cat.1 B.降低反应温度
C.投料比不变,增加反应物的浓度 D.减小CO2和H2的初始投料比

(3)在上述反应中,混合气体CO、CO2和H2的组成关系为n(H2)/n(CO+ CO2)=2.60时,体系中的CO平衡转化率α(CO)与温度和压强的关系如图所示:
①图中的压强由大到小的顺序为____________。
②α(CO)值随温度升高而变小的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,同体积的甲烷(CH4)和二氧化碳原子总数之比为_____,密度之比为_____。
(2)在标准状况下,CO和CO2的混合气体共39.2L,质量为61g,则其中CO2为____ mol。
(3)9.03×1023个NH3含___mol氢原子,在标准状况下的体积为____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中可逆反应mA(g)+nB(g)![]() pC(g)+qQ(g) 当m、n、p、q为任意整数时,达到平衡的标志是
pC(g)+qQ(g) 当m、n、p、q为任意整数时,达到平衡的标志是
①体系的压强不再改变
②体系的温度不再改变
③各组分的浓度不再改变
④各组分的质量分数不再改变
⑤反应速率v(A):v(B):v(C):v(D) =m:n:p:q
⑥单位时间内m mol A断键反应,同时pmol C也断键反应
A. ③④⑤⑥ B. ②③④⑥ C. ①③④⑤ D. ①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3molNH3分子中所含原子数与_______个H2O分子中所含原子数相等。
(2)在一定的温度和压强下,1体积气体X2跟3体积气体Y2刚好化合生成2体积气体A,则A的化 学式可表示为________。
(3)在同温同压同体积的条件下,H2与气体B的质量之比是1:8,则B的摩尔质量为________。
(4)在25℃、101kPa的条件下,同质量的CH4和气体C的体积之比是15:8,则C的摩尔质量为_______。
(5)相同温度下在两个相同容积的密闭容器 D、E中,分别充入相同质量的X气体和CO气体,D和E中的压强之比是7:16,则X的摩尔质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
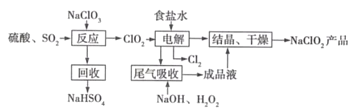
回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式_______。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验.
I、甲同学向1molL﹣1氯化铁溶液中加入少量的NaOH溶液;
II、乙同学直接加热饱和FeCl3溶液;
III、丙同学向25ml沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热. 试回答下列问题:
(1)其中操作正确的同学是_____.写出此过程中的化学方程式:_____________;
(2)证明有Fe(OH)3胶体生成的最简单实验操作是___________________________;
(3)Fe(OH)3胶体是不是电解质:_____ (填“是”或“不是”).
(4)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶粒带_____电荷.
②向其中加入饱和Na2SO4溶液,产生的现象是_________________________________;
③向所得Fe(OH)3胶体中逐滴滴加硫酸溶液,开始产生红褐色沉淀,这是因为_____;继续滴加,沉淀最终消失且得棕黄色溶液,写出化学方程式______________________;
④欲除去Fe(OH)3胶体中混有的NaCl,所用仪器物品是_____;操作名称是_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com