
【题目】氢氧化钡是分析化学中的重要试剂。工业上以重晶石矿(主要成分BaSO4,含杂质Fe2O3、SiO2)为原料,生产Ba(OH)2·8H2O的流程示意如下:

已知:高温焙烧,炭还原重晶石的反应方程式为:BaSO4+4C![]() CO↑+BaS
CO↑+BaS
(1)氢氧化钡的电子式为___________。
(2)水浸并过滤后的滤渣中含三种单质,分别为C、______和____ (填化学式),滤液1显______(填“酸性”或“碱性”)。向滤液1中加入CuO后,会生成黑色沉淀,该反应的化学方程式为___________。
(3)还可采用如下流程对滤液1进行处理:

若D物质为AB型,其组成与MnO2相同,滤液1中加入MnO2的化学方程式为_______。该方法的优点是_____。
(4)由滤液2得到产品需采用的操作是___________、___________、过滤。
【答案】![]() Fe Si 碱性 BaS+CuO+H2O=CuS+Ba(OH)2 BaS+ MnO2 +H2O=MnO+S+ Ba(OH)2 MnO2可以循环利用 蒸发浓缩 冷却结晶
Fe Si 碱性 BaS+CuO+H2O=CuS+Ba(OH)2 BaS+ MnO2 +H2O=MnO+S+ Ba(OH)2 MnO2可以循环利用 蒸发浓缩 冷却结晶
【解析】
(1)根据电子式的书写规则氢氧化钡的电子式为: ![]() ;
;
(2) 在焙烧过程中,碳将Fe2O3、SiO2中的Fe和Si还原出来,所以水浸并过滤后的滤渣中有Fe和Si;根据题干信息,BaS在水浸时发生水解反应生成氢氧化钡,所以滤液呈碱性;向滤液1中加入CuO后发生反应为:BaS+CuO+H2O=CuS+Ba(OH)2;故答案为:Fe;Si;碱性;BaS+CuO+H2O=CuS+Ba(OH)2;
(3)由图示及二氧化锰的氧化性可得该反应方程式为:BaS+MnO2+H2O=MnO+S+Ba(OH)2,该方法的优点是MnO2可以循环利用,故答案为:BaS+MnO2+H2O=MnO+S+Ba(OH)2;MnO2可以循环利用;
(4)根据氢氧化钡的溶解性可知要获取Ba(OH)2·8H2O需采用的操作是蒸发浓缩、冷却结晶、过滤,故答案为:蒸发浓缩;冷却结晶。


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】2018年8月3日我国确诊首例非洲猪瘟疫情。10月25日,农业农村部新闻办公室发布,贵州省毕节市发生非洲猪瘟疫情。目前最有效的药物要主要成分的一种合成路线如图所示:

已知:
①E、G能发生银镜反应
②R—CHO+R′—CH2—CHO ![]()
 (R、R表示烃基或氢)。
(R、R表示烃基或氢)。
请回答下列问题:
(1)G的名称是____________________;D中所含官能团的名称是____________________。
(2)Y的结构简式为__________________;A生成B的反应类型是__________________。
(3)据最新报道,乙烯与双氧水在催化剂作用下反应生成B,产率较高。写出该反应的化学方程式____________________________________________。
(4)简述逐一检测出F中官能团的实验操作与现象结论______________________。
(5)在J的同分异构体中,同时满足下列条件的同分异构体有___________种。
i.既能发生水解反应,又能发生银镜反应;
ii.遇氯化铁溶液发生显色反应。
(6)参照上述流程,以苯乙烯为原料,设计路线制备某药物中间体
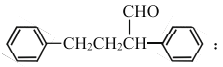 _________________________________。
_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.用固体烧碱配制480mL 0.1 mol·L-1的NaOH溶液,请回答以下问题:
(1)需称量_______g烧碱固体,它应盛在_____中进行称量。
(2)配制过程中,不需要使用的仪器是(填序号)_____________。
A、托盘天平 B、药匙 C、烧杯 D、胶头滴管 E、玻璃棒 F、1000mL容量瓶 G、500mL容量瓶
(3)若配制0.1 mol·L-1的NaOH溶液的其他操作均正确,但出现下列错误操作,其中将使配制的NaOH溶液浓度偏高的是___________(填序号)。
A.将NaOH溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
B.将烧杯内的NaOH溶液向容量瓶中转移时,因操作不当使部分溅出瓶外
C.定容摇匀后,发现液面低于刻度线,又加水至液面与刻度线相切
D.定容时俯视容量瓶的刻度线
Ⅱ.欲用98% 的浓硫酸(ρ=1.84 g·cm-3 )配制成浓度为0.5 mol·L-1 的稀硫酸480mL。
(1)所需浓硫酸的体积为___mL。
(2)选用的主要仪器有:烧杯、量筒、胶头滴管、玻璃棒和___。
(3)操作正确的顺序为_____(填序号)。
A.用量筒量取浓硫酸 B.反复颠倒摇匀 C.用胶头滴管加水至刻度
D.将配制好的溶液转入试剂瓶中贴上标签 E.稀释浓硫酸 F.将溶液转入容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁。下列说法不正确的是

A. 步骤②中分离操作的名称是过滤,Mg(OH)2可以作阻燃剂是因为它分解需要吸收大量的热
B. 步骤①中的反应式:3Fe(OH)3 +S2O42-+2OH- =3Fe(OH)2 +2SO42-+4H2O
C. 步骤①中保险粉是作还原剂
D. 从步骤② 中可知OH- 和EDTA共存时,Fe2+更易和EDTA结合,生成可溶性化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电镀车间的含铬酸性废水中,铬的存在形式有Cr(Ⅵ)和Cr(Ⅲ)两种,其中以Cr(Ⅵ)的毒性最大。电解法处理含铬废水如图,铬最终以Cr(OH)3沉淀除去。下列说法正确的是
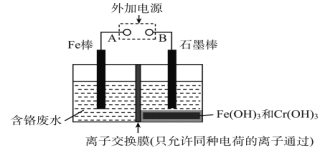
A. Fe为阳极,反应为Fe-2e-=Fe2+
B. 阴极反应为Cr2O72-+7H2O+6e-=2Cr(OH)3↓+8OH-
C. 阳极每转移3mol电子,可处理Cr(Ⅵ)物质的量为1mol
D. 离子交换膜为质子交换膜,只允许H+穿过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种有机盐 X(仅含四种元素)的组成与性质,设计并完成如下实验:

已知: A为两种常见气体的混合物, B、 C 均为常见物质。
(1)X中除含有氢、氧元素外,还含有的元素为:________________(写元素名称)。
(2)写出 X 受热分解的化学方程式:____________________________________________。
(3)设计实验验证“红棕色固体”中金属阳离子______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是一座开放的“元素大厦”,”元素大厦”尚未客满。若发现120号元素,请在“元素大厦”中安排好它的“房间”
A.第七周期0族B.第七周期第IIA族C.第八周期第IIA族D.第八周期第IA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com