
【题目】现有短周期元素性质的部分数据如下表,其中x的值表示不同元素的原子吸引电子的能力大小,若x值越大,元素的非金属性越强,金属性越弱。x值相对较大的元素在所形成的分子中化合价为负。⑩原子的核外电子层数与核外电子总数相同。
元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
x | 3.44 | 2.55 | 0.98 | 3.16 | 2.19 | 3.98 | 0.93 | 3.04 | 1.91 | |
常见化合价 | 最高价 | +4 | +1 | +1 | +4 | |||||
最低价 | -2 | -1 | -3 | -1 | -3 | |||||
(1)根据以上条件,推断③④⑤的元素符号分别为:___,__,__。
(2)②的最高价氧化物的固体属于__晶体,空间构型__。
(3)用电子式表示下列原子相互结合成的化合物电子式:
①+⑦+⑩:___,
①+⑩形成原子个数比为1:1的化合物:__。
(4)写出①与⑦所形成仅含离子键的化合物和④与⑩所形成的化合物反应的离子方程式:___。
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】“中和滴定”原理在实际生产生活中应用广泛。用I2O5可定量测定CO的含量,该反应原理为5CO+I2O5![]() 5CO2+I2。其实验步骤如下:
5CO2+I2。其实验步骤如下:
①取250 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管中在170 ℃下充分反应;
②用水一乙醇液充分溶解产物I2,配制100 mL溶液;
③量取步骤②中溶液25.00 mL于锥形瓶中,然后用0.01 mol·L-1的Na2S2O3标准溶液滴定。消耗标准Na2S2O3溶液的体积如表所示。
第一次 | 第二次 | 第三次 | |
滴定前读数/mL | 2.10 | 2.50 | 1.40 |
滴定后读数/mL | 22.00 | 22.50 | 21.50 |
(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和____________________。
(2)Na2S2O3标准液应装在__________(填字母)中。

(3)指示剂应选用__________,判断达到滴定终点的现象是____________________________________。
(4)气体样品中CO的体积分数为__________(已知:气体样品中其他成分不与I2O5反应:2Na2S2O3+I2=2NaI+Na2S4O6)
(5)下列操作会造成所测CO的体积分数偏大的是__________(填字母)。
a.滴定终点俯视读数
b.锥形瓶用待测溶液润洗
c.滴定前有气泡,滴定后没有气泡
d.配制100 mL待测溶液时,有少量溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是

A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A. 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 晶体的晶胞结构与
晶体的晶胞结构与![]() 晶体的相似(如下图所示),但
晶体的相似(如下图所示),但![]() 晶体中由于哑铃形
晶体中由于哑铃形![]() 的存在,使晶胞沿一个方向拉长。则关于
的存在,使晶胞沿一个方向拉长。则关于![]() 晶体的描述不正确的是( )
晶体的描述不正确的是( )
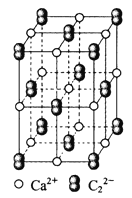
A.![]() 晶体的熔点较高,硬度也较大
晶体的熔点较高,硬度也较大
B.与![]() 距离相同且最近的
距离相同且最近的![]() 构成的多面体是正六面体
构成的多面体是正六面体
C.与![]() 距离相同且最近的
距离相同且最近的![]() 有4个
有4个
D.上图的结构中共含有4个![]() 和4个
和4个![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是前36号元素。其中A与B在周期表中位置相邻,A原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;B的基态原子有7种不同运动状态的电子;C原子在同周期原子中原子半径最大(稀有气体除外);D原子的L电子层中有两个未成对电子,且无空轨道;E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、D四种元素第一电离能从小到大顺序为_____。
(2)A的稳定氧化物中,中心原子的杂化类型为____,空间构型为_____。
(3)C与电负性最大的元素形成的化合物与B的氢化物熔沸点______更高,原因是_______。
(4)E的某种化合物的结构如图所示。
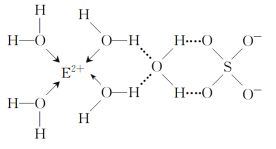
微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有____。
A: 离子键 B: 共价键 C: 配位键 D: 氢键
(5)元素金(Au)处于周期表中的第六周期,与E同族。一种E合金晶体具有立方最密堆积的结构,在晶胞中E原子处于面心,金原子处于顶点位置,则该合金中E原子与金原子数量之比为____;该晶体中,原子之间的作用力是_____。
(6)上述晶体具有储氢功能,氢原子可进入到由铜原子与金原子构成的四面体空隙中。若将铜原子与金原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式应为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态O原子核外电子排布式为_______,基态P原子核外占据最高能级的电子云轮廓图为_________形;
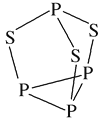
(2)P4S3可用于制造火柴,其分子结构如图所示。P4S3分子中硫原子的杂化轨道类型为___________,每个P4S3分子中含孤电子对的数目为_______。
(3)Na、O、S简单离子半径由大到小的顺序为__________
(4)SO2易溶于水,在水中的溶解度为1体积的水溶解40体积的SO2,原因是________。
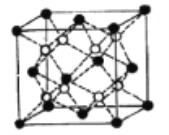
(5)Li2O的晶胞如图所示(其中白球代表Li,黑球代表O)。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,已知PdI2在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
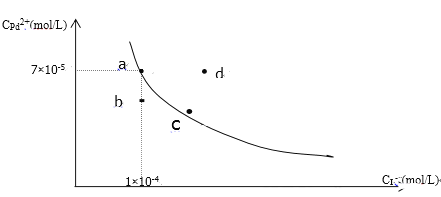
A. 在t℃时PdI2的Ksp=7.0×10-9
B. 图中a点是饱和溶液,b、d两点对应的溶液都是不饱和溶液
C. 向a点的溶液中加入少量NaI固体,溶液由a点向c点方向移动
D. 要使d点移动到b点可以降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素类化合物常用于治疗血栓性疾病,由 4-羟基香豆素(X)和苯代亚苄基丙酮(Y)反应可得到苯代苄丙酮香豆素(Z)。
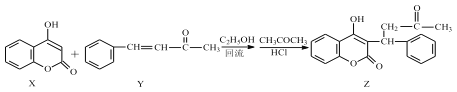
下列说法正确的是
A.X、Y 生成 Z 的反应为加成反应
B.Z 分子中所有碳原子可能共平面
C.1mol 化合物 X 最多能与 1mol NaOH 反应
D.1 mol 化合物 Y 最多能与 5 mol H2 发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com