
【题目】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1) CO2经催化加氢可合成低碳烯烃: 2CO2(g)+6H2(g)CH4(g)+4H2O(g),正反应放热。在1L恒容密闭容器内,按n(CO2): n(H2)=1:3投料,测得各组分物质的量随时间变化如下图所示:
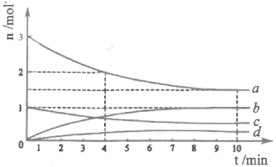
①该反应的△H____(填 “>”,“=”或“<" )0。
②曲线b表示的物质为____ (填化学式),该物质在0~4min内的平均反应速率为______。(保留2位小数)
(2)一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如下图所示
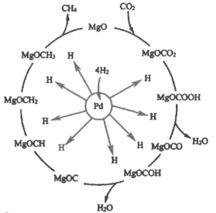
①该反应的化学方程式为_________;
②理论上每有1mol CO2参加反应,反应过程中转移的电子数为_______ mol.
【答案】< H2O 0.17molL-1min-1 CO2+4H2 ![]() CH4+ 2H2O 8
CH4+ 2H2O 8
【解析】
对于2CO2(g)+6H2(g)CH4(g)+4H2O(g)来说,按n(CO2): n(H2)=1:3投料,反应从正向开始进行,CO2和H2的物质的量不断减少,CH4和H2O的物质的量不断增加,直至达到平衡;从反应机理图示可知,反应物为CO2和H2,生成物为CH4和H2O。
(1) ①由题意可知,该反应的正反应为放热反应,故△H<0。
②b的物质的量增加了1mol,d的物质的量增加小于b,根据反应方程式可知,CH4(g)与H2O(g)的生成量比为1:4,故b为H2O。
(2) ①根据图示可知,反应物为CO2和H2,生成物为CH4和H2O,则该反应的化学方程式为CO2+4H2 ![]() CH4+ 2H2O;
CH4+ 2H2O;
②根据反应方程式可知,碳元素化合价由+4价变为-4价,故理论上每有1mol CO2参加反应,反应过程中转移的电子数为8mol。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列装置中同时通入a、b两种气体,瓶中实验现象错误的是
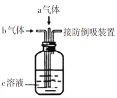
选项 | a气体 | b气体 | c溶液 | 实验现象 |
A | Cl2(1mol) | SO2(1mol) | 品红溶液 | 溶液颜色变浅或褪色 |
B | H2S | SO2 | 水 | 产生淡黄色沉淀 |
C | SO2 | NO2 | BaCl2溶液 | 产生白色沉淀 |
D | NO | O2 | 滴加少量酚酞的NaOH溶液 | 溶液颜色变浅或褪色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用洗净的废铜屑作原料来制备硝酸铜。为了节约原料和防止污染环境,宜采取的方法是
A. Cu![]() CuSO4
CuSO4![]() Cu(NO3)2
Cu(NO3)2
B. Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
C. Cu![]() Cu(NO3)2
Cu(NO3)2
D. Cu![]() Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料, 可用作止痛剂、退热剂、防腐剂和染料中间体,乙酰苯胺的制备原理为:![]() +CH3COOH
+CH3COOH![]() +H2O,有关物质的性质如下表:
+H2O,有关物质的性质如下表:
名称 | 式量 | 性状 | 密度/g·cm-3 | 沸点/℃ | 溶解度 | |
苯胺 | 93 | 无色油状液体,易氧化 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 | 易溶于乙醇、乙醚 |
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。
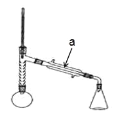
实验步骤:
步骤 1:在圆底烧瓶中加入无水苯胺 9.2 mL,冰醋酸 17.4 mL,锌粉 0.1 g,安装仪器, 加入沸石,调节加热温度,使分馏柱顶温度控制在 105℃ 左右,反应约 60~80 min,反应 生成的水及少量醋酸被蒸出。
步骤 2:在搅拌下,趁热将烧瓶中的物料以细流状倒入盛 100 mL 冰水的烧杯中,剧烈搅拌,并冷却,结晶,抽滤、洗涤、干燥,得到乙酰苯胺粗品。
步 骤 3:将此粗乙酰苯胺进行重结晶,晾干,称重,计算产率。
(1)仪器 a 的名称____________________;
(2)步骤 1 加热可用______________(填“水浴”或“油浴”);
(3)制备过程中加入粒的作用:___________________;
(4)从化学平衡的角度分析,控制分馏柱上端的温度在 105℃左右的原因_______________________;
(5)乙酰苯胺粗品因含杂质而显色,欲用重结晶进行提纯,步骤如下:粗产品溶于沸水中配 成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→趁热过滤→________________→过 滤→洗涤→干燥;
(6)该实验最终得到纯品 10.8g,则乙酰苯胺的产率是______________;
(7)如果重结晶过程中,加入活性炭过多,会造成产率下降,其可能原因为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。

(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。指明使用镁条和氯酸钾的目的是___________________。
(2)某同学用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液未见红色。为测定该实验所得“铁块”中铁元素含量,设计实验流程如图所示。
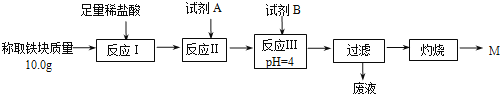
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
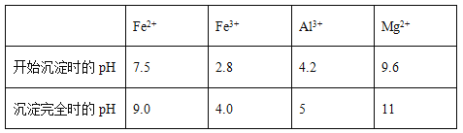
① 试剂A应选择________,试剂B应选择_______(填序号)。
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水
② 写出反应Ⅱ的离子方程式____________________________。
③ 设计简单实验证明M的成分是Fe2O3而非Fe3O4__________。

④ 上述实验应灼烧至M质量不变,则能证明M质量不变的标志是_______。
⑤ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有关事实分析不正确的是
选项 | 事实描述 | 相关知识分析 |
A | 谚语“正月打雷麦谷堆”、“雷雨肥庄稼” | 自然固氮:N2+2O2 |
B | 成语“滴水石穿” | 包含CaCO3+CO2+H2O=Ca(HCO3)2 |
C | 《木草经集注》记载“强烧之,紫青烟起,云是真硝石也。” | “硝石”为KNO3,钾元素的焰色反应为紫色 |
D | 野外之鬼磷,其火色青,其状如炬,或聚或散,俗称鬼火,实乃诸血之磷光也。 | “磷光”是指磷化氢(PH3)自燃,将化学能转化为光能 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的信息,下列叙述正确的是( )
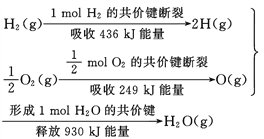
A. 2 mol H2(g)跟 1 mol O2(g)反应生成 2 mol H2O(g)吸收能量为490 kJ
B. 化学反应中能量变化的大小与反应物的质量多少无关
C. 1 mol H2(g) 跟0.5mol O2(g) 反应生成 1 mol H2O(l)释放能量为245 kJ
D. 2molH2O (g)的能量比2 mol H2(g)与1 mol O2(g)的能量之和低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡常数K的数值大小是衡量化学反应进行程度的标志,下列反应的平衡常数数值如下:
2NO(g) N2(g)+ O2(g) K1=1×1030
2H2(g)+ O2(g) 2H2O(g) K2=2×1081
2CO2(g) 2CO(g)+ O2(g) K3=4×10﹣92
以下说法正确的是( )
A. NO分解产生O2的反应的平衡常数表达式K1=c(N2)c(O2)/c(NO)
B. 水分解产生O2,此时平衡常数的数值约为5×10﹣80
C. NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D. 以上说法都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
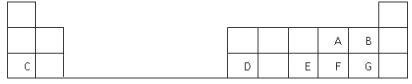
(1)画出C的原子结构示意图__________。
(2)D在元素周期表中的位置是第三周期第________族。
(3)A、B、E、F、G五种元素所形成的气态氢化物最不稳定的是__________(填化学式)。
(4)E、F元素的最高价氧化物对应水化物的酸性较强的是____________(填化学式)。
(5)写出C和F形成的化合物的电子式______________________。
(6)A、C、D的简单离子半径大小关系是__________________ (用离子符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com