
【题目】常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。
(制备产品)将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。
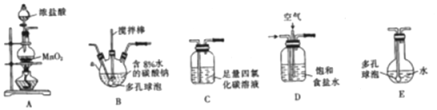
(1)各装置的连接顺序为______→ → →C→ 。
(2)装置B中多孔球泡和搅拌棒的作用是____________________________________ ;装置C的作用是_____________________。
(3)制备Cl2O的化学方程式为________________________。
(4)反应过程中,装置B需放在冷水中,其目的是_____________________________。
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是_______。
【答案】A→D→B→C→E 增大反应物接触面积,使反应充分进行,加快反应速率 除去Cl2O中的Cl2。 2Cl2+Na2CO3=Cl2O+2NaCl+CO2(或者2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3) 防止反应放热后温度过高导致Cl2O分解 制得的次氯酸溶液纯度较高,浓度较大
【解析】
(1)根据实验目的,要将Cl2和空气混合通入含Na2CO3溶液中制备Cl2O,应先用装置A制备Cl2,再通过装置D除去混合气体中的HCl气体,同时混入空气,将混合气体通入装置B,在装置B中发生制备Cl2O的反应;然后将制取的Cl2O气体先通入装置C,以除去Cl2杂质气体,最后通过装置E制取次氯酸溶液,故装置的连接顺序为A→D→B→C→E。答案:A→D→B→C→E。
(2)多孔球泡和搅拌棒均能增大反应物的接触面积,加快反应速率,使反应充分快速进行。装置C的作用是除去Cl2O中的Cl2。答案:增大反应物接触面积,使反应充分进行,加快反应速率 、除去Cl2O中的Cl2。
(3)已知空气不参与反应,则制取Cl2O以Cl2和Na2CO3为反应物,发生歧化反应,其中氯元素从0价变为+1价和-1价,反应的化学方程式为:2Cl2+Na2CO3=Cl2O+2NaCl+CO2或2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3。
(5)已知Cl2O在42 ℃以上会分解生成Cl2和O2,因此反应过程中,装置B需放在冷水中,防止反应放热后温度过高导致Cl2O分解。答案:防止反应放热后温度过高导致Cl2O分解。
(6)Cl2O与水反应的化学方程式为:Cl2O+H2O= 2HClO ,Cl2和水反应的化学方程式为Cl2+H2O![]() HClO+HCl,Cl2O和水反应只生成HClO 且反应不可逆,Cl2和水反应除了生成HClO还生成HCl,并且反应可逆,所以用Cl2O与水反应制备次氯酸溶液的主要优点是用Cl2O与水反应制备次氯酸溶液时制得次氯酸溶液纯度较高、浓度也较大。答案:制得的次氯酸溶液纯度较高,浓度较大。
HClO+HCl,Cl2O和水反应只生成HClO 且反应不可逆,Cl2和水反应除了生成HClO还生成HCl,并且反应可逆,所以用Cl2O与水反应制备次氯酸溶液的主要优点是用Cl2O与水反应制备次氯酸溶液时制得次氯酸溶液纯度较高、浓度也较大。答案:制得的次氯酸溶液纯度较高,浓度较大。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某种烃的衍生物分子式为C2H6O,下面是探讨其分子结构的过程,请回答相关问题:
(1)按价键理论,写出C2H6O可能有的结构式(用A、B、C……标明序号)_________________;
(2)取一定量的C2H6O与足量的金属钾反应,收集产生的气体,当完全反应时,C2H6O与产生的气体物质的量之比为2∶1。
①产生的气体能燃烧,火焰呈淡蓝色,燃烧产物通入无水硫酸铜,固体变蓝色;通入澄清石灰水,不变浑浊,则C2H6O与钾反应产生的气体是______________________________;
②据实验数据,可确定C2H6O的结构式为(写自编号)________,推断过程是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,写出表示硫的燃烧的热化学方程式_____________________________________。
(2)如图是298 K、101 kPa时,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:

回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________________;得到滤渣1的主要成分为________________。
(2)第②步加入H2O2的作用是______________________________________,使用H2O2的优点是______________________________________________;调节pH的目的是使_______________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_______________________。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
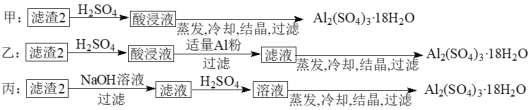
上述三种方案中,______方案不可行 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是( )
A. 硫酸、CuSO45H2O,苛性钾
B. 硫酸、空气、纯碱
C. 氧化铁、胆矾、熟石灰
D. 硝酸、食盐水、烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.0 kJ/mol,下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-542.7kJ/mol
B. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1059.3kJ/mol
C. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7kJ/mol
D. N2H4(g)+![]() N2O4(g)=
N2O4(g)=![]() N2(g)+2H2O(g) ΔH=-1076.7kJ/mol
N2(g)+2H2O(g) ΔH=-1076.7kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO和H2合成CH3OH的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )
CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )

A. 温度:T1>T2>T3
B. 正反应速率:v(a)>v(c), v(b)>v(d)
C. 平衡常数:K(a)>K(c),K(b)=K(d)
D. 平均摩尔质量:M(a)<M(c),M(b)<M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、实验现象和实验结论均正确的是( )
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 将Al2(SO4)3溶液和NaHCO3溶液混合 | 产生白色沉淀,并有大量气体生成 | 生成Al2(CO3)3沉淀和CO2气体 |
B | 在淀粉溶液中加入几滴稀硫酸,水浴5min,加入NaOH溶液调溶液pH至碱性,再加入新制的Cu(OH)2悬浊液,加热 | 有红色沉淀生成 | 淀粉完全水解 |
C | 将少量SO2气体通过足量Na2O2 | 余下气体能使带火星木条复燃 | 有O2生成 |
D | 用pH试纸分别测定等浓度的A、B两溶液(可能为NaHCO3或者Na2CO3)的pH值 | pHA> pHB | A溶液为Na2CO3溶液 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com