
【题目】下列实验操作、实验现象和实验结论均正确的是( )
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 将Al2(SO4)3溶液和NaHCO3溶液混合 | 产生白色沉淀,并有大量气体生成 | 生成Al2(CO3)3沉淀和CO2气体 |
B | 在淀粉溶液中加入几滴稀硫酸,水浴5min,加入NaOH溶液调溶液pH至碱性,再加入新制的Cu(OH)2悬浊液,加热 | 有红色沉淀生成 | 淀粉完全水解 |
C | 将少量SO2气体通过足量Na2O2 | 余下气体能使带火星木条复燃 | 有O2生成 |
D | 用pH试纸分别测定等浓度的A、B两溶液(可能为NaHCO3或者Na2CO3)的pH值 | pHA> pHB | A溶液为Na2CO3溶液 |
A. A B. B C. C D. D
【答案】D
【解析】
A、利用HCO3-的水解,进行分析;B、淀粉水解分为未水解、部分水解、全部水解,当淀粉部分水解或全部水解时,都具有上述现象;C、SO2以还原性为主,Na2O2具有强氧化性,两者能发生氧化还原反应,生成Na2SO4,没有氧气生成;D、同温下,相同浓度的Na2CO3和NaHCO3溶液,Na2CO3溶液的碱性强。
A、HCO3-发生水解:HCO3-+H2O![]() H2CO3+OH-,Al3+与OH-结合成Al(OH)3,促使HCO3-水解,其反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑,故A错误;B、淀粉在酸性条件下水解成葡萄糖,葡萄糖与新制氢氧化铜悬浊液生成砖红色沉淀,如果淀粉部分水解,此溶液中有葡萄糖,按照上述操作,也可以得到红色沉淀,故B错误;C、SO2具有还原性,Na2O2具有强氧化性,因为SO2是少量,因此生成的产物是Na2SO4,无氧气生成,故C错误;D、CO32-的水解程度大于HCO3-,因此相同浓度下,Na2CO3溶液的碱性强于NaHCO3,故D正确。
H2CO3+OH-,Al3+与OH-结合成Al(OH)3,促使HCO3-水解,其反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑,故A错误;B、淀粉在酸性条件下水解成葡萄糖,葡萄糖与新制氢氧化铜悬浊液生成砖红色沉淀,如果淀粉部分水解,此溶液中有葡萄糖,按照上述操作,也可以得到红色沉淀,故B错误;C、SO2具有还原性,Na2O2具有强氧化性,因为SO2是少量,因此生成的产物是Na2SO4,无氧气生成,故C错误;D、CO32-的水解程度大于HCO3-,因此相同浓度下,Na2CO3溶液的碱性强于NaHCO3,故D正确。


科目:高中化学 来源: 题型:
【题目】常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。
(制备产品)将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。
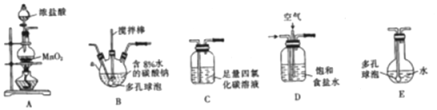
(1)各装置的连接顺序为______→ → →C→ 。
(2)装置B中多孔球泡和搅拌棒的作用是____________________________________ ;装置C的作用是_____________________。
(3)制备Cl2O的化学方程式为________________________。
(4)反应过程中,装置B需放在冷水中,其目的是_____________________________。
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中的前四周期,两两相邻的5种元素如图所示,若B元素的核电荷数为a。下列说法正确的是( )
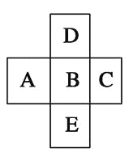
A. B、D的原子序数之差可能为2
B. E、B的原子序数之差可能是8、18或32
C. A、E的原子序数之差可能是7
D. 5种元素的核电荷总数之和可能为5a+10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如图),下列对于试管内发生的反应及现象的说法正确的是( )
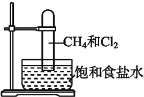
A. 此反应无光照也可发生
B. 盛放饱和食盐水的水槽底部会有少量晶体析出
C. 甲烷和Cl2反应后的产物只有CH3Cl和HCl
D. CH4和Cl2完全反应后液面上升,液体充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】李克强总理在《2018年国务院政府工作报告》中强调“今年二氧化硫、氮氧化物排放量要下降3%。”研究烟气的脱硝(除NOx)、脱硫(除SO2)有着积极的环保意义。
Ⅰ. 汽车排气管上安装“催化转化器”,其反应的热化学方程式为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO的物质的量随时间变化如图。
2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO的物质的量随时间变化如图。
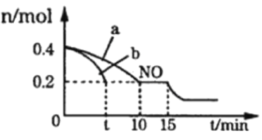
(1)图中a、b分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (NO)的变化曲线,其中表示催化剂表面积较大的曲线是______(填“a”或“b”)
(2)在a曲线所示反应中,0~10min内,CO的平均反应速率v(CO)=___________;T℃时,该反应的化学平衡常数K=_____________;平衡时若保持温度不变,再向容器中充入CO、CO2各0.2 mol,则平衡将_________移动(填“向左”、“向右”或“不”)
(3)15min时, n (NO)发生图中所示变化,则改变的条件可能是_______(填序号)
A.充入少量CO B.将N2液化移出体系 C.升高温度 D.加入催化剂
Ⅱ. 已知有下列反应:
①5O2(g)+ 4NH3(g)![]() 6H2O(g)+ 4NO(g) △H1
6H2O(g)+ 4NO(g) △H1
②N2(g)+O2(g)![]() 2NO(g) △H2
2NO(g) △H2
③2NO(g)+ O2(g)![]() 2NO2(g) △H3
2NO2(g) △H3
(1)若在高效催化剂作用下可发生8NH3(g)+ 6NO2(g)![]() 7N2(g)+ 12H2O(g)的反应,对NO2进行处理则该反应的△H=__________(用△H1,△H2,△H3表示),△S______0
7N2(g)+ 12H2O(g)的反应,对NO2进行处理则该反应的△H=__________(用△H1,△H2,△H3表示),△S______0
(2)某温度下,向某恒容密闭容器中充入一定量的NH3和NO2,按照(1)的原理模拟污染物的处理。若容器中观察到________________(填序号),可判断该反应达到平衡状态
A.混合气体颜色不再改变 B. 混合气体的密度不再改变
C.混合气体摩尔质量不再改变 D. NH3和NO2的物质的量之比不再改变
(3)将一定比例的O2、NH3和NO2的混合气体,匀速通入图(a)所示装有催化剂M的反应器中充分进行反应。
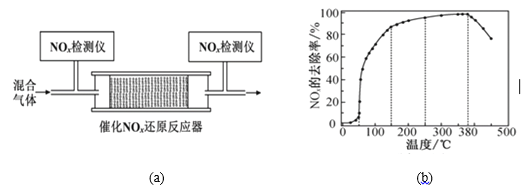
反应相同时间NOx的去除率随反应温度的变化曲线如图(b)所示。已知该催化剂在100~150℃时活性最高,那么在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢,其中去除率迅速上升段的主要原因是____________________________;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瓷器(英文名为________)成了中华民族文化的象征之一;作为陶瓷的故乡,我国陶都________的陶器和瓷都________的瓷器,在世界上都享有盛誉.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
SO2(g)+1/2O2(g)![]() SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
A. 196.64 kJ B. 196.64 kJ/mol C. <196.64 kJ D. >196.64 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示。A为地壳中含量仅次于氧的非金属元素的单质。
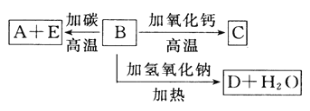
请填空:
(1)形成单质A的原子的结构示意图为______,它的最高化合价为______。
(2)B的化学式(分子式)为______,B和碳反应生成A和E的化学方程式是____________。
(3)C的化学式(分子式)为___________,D的化学式(分子式)为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com