
【题目】如图为以惰性电极进行电解的装置: 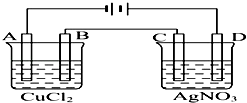
(1)写出A、B、C、D各电极上的电极反应式和总反应方程式: A: , B: , 总反应方程式:;
C: , D: , 总反应方程式: .
(2)在A、B、C、D各电极上析出生成物的物质的量之比为 .
(3)A极发生反应,B极发生反应.(填“氧化”或是“还原”)
【答案】
(1)Cu2++2e﹣═Cu;2Cl﹣﹣2e﹣═Cl2↑;CuCl2![]() Cu+Cl2↑;2Ag++2e﹣═2Ag;4OH﹣﹣4e﹣═2H2O+O2↑;4AgNO3+2H2O
Cu+Cl2↑;2Ag++2e﹣═2Ag;4OH﹣﹣4e﹣═2H2O+O2↑;4AgNO3+2H2O ![]() 4Ag+4HNO3+O2↑
4Ag+4HNO3+O2↑
(2)2:2:4:1
(3)还原;氧化
【解析】解:(1)该装置中AC是阴极、BD是阳极,A电极上铜离子放电生成Cu、B电极上氯离子放电生成氯气,所以相当于电解氯化铜生成Cu和氯气,所以A、B、电池反应式分别为Cu2++2e﹣═Cu、2Cl﹣﹣2e﹣═Cl2↑、CuCl2 ![]() Cu+Cl2↑;C电极上银离子放电生成Ag,D电极上氢氧根离子放电生成氧气和水,所以该电池中相当于电解硝酸银和水生成Ag、硝酸和氧气,所以C、D、电池反应式分别为2Ag++2e﹣═2Ag、4OH﹣﹣4e﹣═2H2O+O2↑、4AgNO3+2H2O
Cu+Cl2↑;C电极上银离子放电生成Ag,D电极上氢氧根离子放电生成氧气和水,所以该电池中相当于电解硝酸银和水生成Ag、硝酸和氧气,所以C、D、电池反应式分别为2Ag++2e﹣═2Ag、4OH﹣﹣4e﹣═2H2O+O2↑、4AgNO3+2H2O ![]() 4Ag+4HNO3+O2↑;
4Ag+4HNO3+O2↑;
所以答案是:Cu2++2e﹣═Cu;2Cl﹣﹣2e﹣═Cl2↑;CuCl2 ![]() Cu+Cl2↑;2Ag++2e﹣═2Ag;4OH﹣﹣4e﹣═2H2O+O2↑;4AgNO3+2H2O
Cu+Cl2↑;2Ag++2e﹣═2Ag;4OH﹣﹣4e﹣═2H2O+O2↑;4AgNO3+2H2O ![]() 4Ag+4HNO3+O2↑;(2)A、B、C、D电极反应式分别为Cu2++2e﹣═Cu、2Cl﹣﹣2e﹣═Cl2↑、2Ag++2e﹣═2Ag、4OH﹣﹣4e﹣═2H2O+O2↑,当都转移2mol电子时,A、B、C、D电极上生成的物质物质的量分别是1mol、1mol、2mol、0.5mol,其物质的量之比=1mol:1mol:2mol:0.5mol=2:2:4:1,
4Ag+4HNO3+O2↑;(2)A、B、C、D电极反应式分别为Cu2++2e﹣═Cu、2Cl﹣﹣2e﹣═Cl2↑、2Ag++2e﹣═2Ag、4OH﹣﹣4e﹣═2H2O+O2↑,当都转移2mol电子时,A、B、C、D电极上生成的物质物质的量分别是1mol、1mol、2mol、0.5mol,其物质的量之比=1mol:1mol:2mol:0.5mol=2:2:4:1,
所以答案是:2:2:4:1;(3)A电极上得电子发生还原反应,被还原,B电极上失电子发生氧化反应,被氧化,
所以答案是:还原;氧化.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
【题目】依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成.下列说法不正确的是( ) 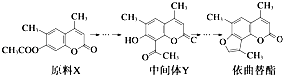
A.原料X与中间体Y互为同分异构体
B.原料X可以使酸性KMnO4溶液褪色
C.中间体Y能发生加成、取代、消去反应
D.1 mol依曲替酯只能与2 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合烃中乙炔的体积分数为( )
A.12.5%
B.25%
C.50%
D.75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是
A.物质的量比为1∶1B.分子数比为16∶11C.体积比为1∶1D.体积比为11∶16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室研究Fe与H2SO4的反应

【实验分析】
(1)实验I中,铁与稀硫酸反应的离子方程式为________________。
(2)实验Ⅱ中,铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止,这一现象被称为___________________。
(3)实验Ⅲ,己知: 浓H2SO4 的沸点为338.2℃,加热试管A,温度保持在250℃~300℃,产生大量气体B中品红褪色,D处始终未检测到可燃性气体。A 中产生的气体是__,装置C 的作用是________________。
(4)实验Ⅲ结束后,经检验A 中既有Fe3+又有不少的Fe2+。
①若要检验Fe3+和Fe2+,下列试剂组可行的是______ (填字母)。
A.KSCN、Fe粉 B.KSCN、酸性KMnO4溶液 C.KSCN、氯水
[实验反思]
(5)①浓硫酸和稀硫酸都具有氧化性,但原因不同,浓硫酸的氧化性源于_____,稀硫酸的氧化性源于_______________。
②影响反应产物多样性的因素有_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题 
(1)肼燃料电池原理如图所示,N2H4通入的一极应为电池的极(填“正”或“负”).
(2)火箭常用N2O4作氧化剂,肼作燃料,已知: N2(g)+2O2(g)═2NO2(g)△H=﹣67.7kJmol﹣1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=﹣534.0kJmol﹣1
2NO2(g)N2O4(g)△H=﹣52.7kJmol﹣1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式 .
(3)联氨的工业生产常用氨和次氯酸钠为原料获得,也可用尿素[CO(NH2)2]和次氯酸钠﹣氢氧化钠溶液反应获得,请写出尿素法反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题: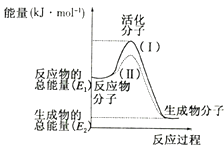
(1)图中所示反应是(填“吸热”或“放热”)反应,该反应的△H=(用含E1、E2的代数式表示).
(2)下列4个反应中符合示意图描述的反应的是 (填代号).
A.水蒸气与炭反应
B.用水稀释氢氧化钠溶液
C.铝粉与Fe2O3反应
D.灼热的碳与CO2反应
(3)已知热化学方程式:H2(g)+ ![]() O2 (g)=H2O(g)△H=﹣241.8kJ/mol.该反应的活化能为167.2kJ/mo1,则其逆反应的活化能为 .
O2 (g)=H2O(g)△H=﹣241.8kJ/mol.该反应的活化能为167.2kJ/mo1,则其逆反应的活化能为 .
(4)以甲烷为原料制取氢气是工业上常用的制氢方法.已知:
CH4 (g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ/mol
CH4(g)+CO2(g)=2CO(g)+2H2 (g)△H=+247.4kJ/mol
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com