
用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g) ΔH<0
Si3N4(s)+12HCl(g) ΔH<0
完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的质量增加了2.80 g,则H2的平均反应速率为________mol/(L·min);该反应的平衡常数表达式K=________。
(2)上述反应达到平衡后,下列说法正确的是________。
a.其他条件不变,压强增大,平衡常数K减小
b.其他条件不变,温度升高,平衡常数K减小
c.其他条件不变,增大Si3N4物质的量平衡向左移动
d.其他条件不变,增大HCl物质的量平衡向左移动
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是________。
a.3v逆(N2)=v正(H2)
b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变
d.c(N2):c(H2):c(HCl)=1:3:6
(4)若平衡时H2和HCl的物质的量之比为m/n,保持其他条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比________m/n(填“>”、“=”或“<”)。
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:填空题
已知下列两个反应:
反应Ⅰ:CO2(g)+H2(g)  CO(g)+H2O ΔH1
CO(g)+H2O ΔH1
反应Ⅱ:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH2
CO2(g)+H2(g) ΔH2
(1)相同温度下,若上述反应Ⅰ的化学平衡常数为K1,反应Ⅱ的化学平衡常数为K2,那么K1·K2=________。
(2)反应Ⅰ化学平衡常数K1和温度t的关系如下表一:
| t/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K1 | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 起始浓度 | 甲 | 乙 | 丙 |
| c(CO2)(mol/L) | 0.01 | 0.02 | 0.02 |
| c(H2)(mol/L) | 0.01 | 0.01 | 0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现将氢气和氮气充入某密闭容器中,在一定条件下反应的有关数据为:
| 项目 | H2 | N2 | NH3 |
| 起始时 | 5 mol·L-1 | 3 mol·L-1 | 0 |
| 2 s末 | 2 mol·L-1 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知CO2(g)+H2(g)  CO(g)+H2O(g)的平衡常数随温度变化如下表:
CO(g)+H2O(g)的平衡常数随温度变化如下表:
| t/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| | A | B | C | D | E |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
| 时间 /min | CO2 (mol·L-1) | H2 (mol·L-1) | CO (mol·L-1) | H2O (mol·L-1) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
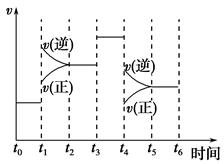
(1)在固定体积的密闭容器中通入N2和H2,下列能说明达到平衡的是________。
| A.3v(N2)=v(H2) |
| B.断裂1个N≡N的同时断裂6个N—H |
| C.N2、H2、NH3的物质的量之比是1∶3∶2 |
| D.容器内气体的压强不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某研究性学习小组探究如下实验:在常温下,取两片质量相等、外形和组成相同且表面经过砂纸打磨完全去掉氧化膜的铝片,分别加入盛有相同体积、H+浓度相同的稀硫酸和稀盐酸的两支大小相同的试管中,发现铝片在稀盐酸中产生氢气的反应速率比在稀硫酸中的快。查阅相关资料后得知:化学反应速率主要由参加反应的物质的性质决定,其次是外界因素的影响。
(1)写出以上反应的离子方程式_______________________________。
(2)出现上述现象的原因可能:假设①SO42—对铝与H+的反应有抑制作用;假设②______________________________________。
(3)请设计实验对上述假设进行验证:
①____________________________________________;
②____________________________________________。
(4)如果上述假设都成立,要使上述稀硫酸与铝反应产生氢气的速率加快,可以采取的措施有:
①__________________________________________________;
②__________________________________________________;
③__________________________________________________;
④__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g)ΔH1
②IO-(aq)+H+(g)=HOI(aq)ΔH2
③HOI(aq)+I-(aq)+H+(aq)=I2(aq)+H2O(l)ΔH3
总反应的化学方程式为_________________________________,
其反应热ΔH=______________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)  I3-(aq),其平衡常数表达式为________。
I3-(aq),其平衡常数表达式为________。
(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如图1),某研究小组测定两组实验中I3-浓度和体系pH,结果见图2和下表。
| 编号 | 反应物 | 反应前pH | 反应前pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:A(g)  B(g)+C(g) ΔH=+85.1 kJ·mol-1
B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
 | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.0065 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
已知COCl2(g)??Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):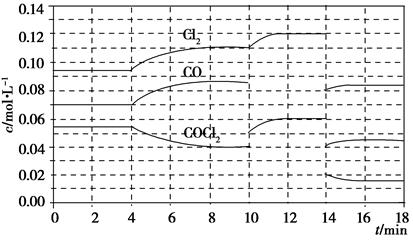
(1)化学平衡常数表达式K=________,计算反应在第8 min时的平衡常数K=________;
(2)比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
(3)若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=________;10~12 min内CO的平均反应速率为v(CO)=________;
(4)比较产物CO在2~3min、5~6min和12~13min时平均反应速率(平均反应速率分别以v(2~3)、v(5~6)、v(12~13))的大小________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com