
【题目】配制240mL 1.00mol/L的H2SO4标准溶液的相关操作:①计算;②量取;③稀释、冷却;④转移、洗涤;⑤定容;⑥摇匀。
(1)现用98%的浓硫酸(密度约为1.8g/cm3)来配制,需用量筒量取浓硫酸的体积为_______________。
(2)实验中所用到的玻璃仪器有烧杯、玻璃棒、量筒、_______________、_______________。
(3)下列操作中会引起所配稀硫酸浓度偏大的操作有_______________。(填字母)
A.用量筒量取浓硫酸时,俯视读数
B.从量筒中倒出量取的浓硫酸后洗涤量筒内壁并把洗涤液转入容量瓶中
C.稀释浓硫酸时有少量液体溅出
D.浓硫酸稀释后未冷却就立即转移到容量瓶中 E.容量瓶中残留少量水即用来配溶液
F.定容摇匀后,发现液面低于刻度线
(4)简述上述配溶液时步骤⑤定容时的操作_______________。
【答案】13.9mL 250mL容量瓶 胶头滴管 BD 先将蒸馏水注入容量瓶,当液面距离容量瓶刻度线12cm时,改用胶头滴管滴加蒸馏水至凹液面最低处与刻度线相切
【解析】
(1)根据![]() 计算该浓硫酸的物质的量浓度,需要配制240mL1.0mol/L的稀硫酸,但是没有240mL容量瓶,应选择250ml容量瓶,因此实际配制溶液的体积为250mL,再根据稀释定律计算;
计算该浓硫酸的物质的量浓度,需要配制240mL1.0mol/L的稀硫酸,但是没有240mL容量瓶,应选择250ml容量瓶,因此实际配制溶液的体积为250mL,再根据稀释定律计算;
(2)根据配制一定物质的量浓度的溶液的步骤:①计算;②量取;③稀释、冷却;④转移、洗涤;判断实验中所用到的玻璃仪器;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据![]() 进行误差分析;
进行误差分析;
(4)定容时,先将蒸馏水注入容量瓶,当液面距离容量瓶刻度线12cm时,改用胶头滴管滴加蒸馏水至凹液面最低处与刻度线相切。
(1)该浓硫酸的质量分数为98%,密度为1.8g/cm3,故该浓硫酸的物质的量浓度![]() ,需要配制240mL 1.0mol/L的稀硫酸,但是没有240mL容量瓶,应选择250ml容量瓶,因此实际配制溶液的体积为250mL,设需要浓硫酸体积为V,根据稀释定律,V×18mol/L=1.0mol/L×0.25L,解得V=13.9mL;
,需要配制240mL 1.0mol/L的稀硫酸,但是没有240mL容量瓶,应选择250ml容量瓶,因此实际配制溶液的体积为250mL,设需要浓硫酸体积为V,根据稀释定律,V×18mol/L=1.0mol/L×0.25L,解得V=13.9mL;
故答案为:13.9mL;
(2)根据配制一定物质的量浓度的溶液的步骤:①计算;②量取;③稀释、冷却;④转移、洗涤;⑤定容;⑥摇匀;判断该实验中所用到的玻璃仪器有烧杯、玻璃棒、量筒、250mL容量瓶、胶头滴管;
故答案为:250mL容量瓶;胶头滴管;
(3)![]() ,如果n偏大或V偏小都导致配制溶液浓度偏大;
,如果n偏大或V偏小都导致配制溶液浓度偏大;
A. 用量筒量取浓硫酸时,俯视读数,导致n偏小,则配制溶液浓度偏小,A项错误;
B. 从量筒中倒出量取的浓硫酸后洗涤量筒内壁并把洗涤液转入容量瓶中,导致n偏大,则配制溶液浓度偏大,B项正确;
C. 稀释浓硫酸时有少量液体溅出,n偏小,则配制溶液浓度偏小,C项错误;
D. 浓硫酸稀释后未冷却就立即转移到容量瓶中并完成定容操作,导致V偏小,则配制溶液浓度偏大,D项正确;
E. 容量瓶中残留少量水即用来配溶液,n、V无影响,则配制溶液浓度无影响,E项错误;
F. 定容摇匀后,发现液面低于刻度线,n、V无影响,配制溶液浓度无影响,F项错误;
故答案为:BD;
(4)定容时,先将蒸馏水注入容量瓶,当液面距离容量瓶刻度线12cm时,改用胶头滴管滴加蒸馏水至凹液面最低处与刻度线相切;
故答案为:先将蒸馏水注入容量瓶,当液面距离容量瓶刻度线12cm时,改用胶头滴管滴加蒸馏水至凹液面最低处与刻度线相切。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】过氧化镁(MgO2)不溶于水,与酸反应生成H2O2,在医学上可作解酸剂。常温下MgO2较稳定,加热时会分解生成O2和MgO。MgO与H2O2反应可制得MgO2,同时放出大量热。一种制备MgO2的流程如图所示:
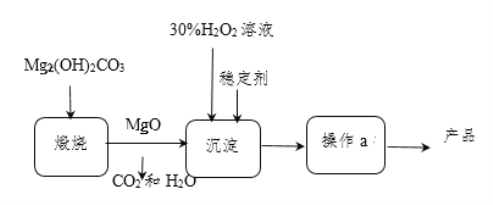
请回答下列问题:
(1)煅烧Mg2(OH)2CO3的化学反应方程式为_______________________;检验Mg2(OH)2CO3已分解完全的方法是______________________________。(写出实验操作和现象)
(2)上述制备过程中加入稳定剂的作用是___________;操作a为_____________。
MgO2产品中常会混有少量MgO,实验室可通过多种方案测定样品中MgO2的含量。某研究小组拟用下图装置测定样品(含MgO杂质)中MgO2的含量。
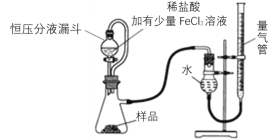
(3)研究小组的实验原理是(用化学方程式表示)①___________________________;
②2H2O2 → 2H2O +O2↑,稀盐酸中加入少量FeCl3溶液的作用是_______________。
(4)实验中使用恒压分液漏斗的优点是:使分液漏斗中的溶液顺利滴下、___________。
(5)反应结束后,先_________________,然后__________________,最后平视刻度线读数并记录。
(6)该小组记录的实验数据如下,样品的质量为m g;反应开始前量气管的读数为a mL;反应结束后量气管的读数为b mL,则样品中过氧化镁的质量分数为______(该实验条件下O2密度为ρ gL-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有氮及其化合物的转化关系如下图,则下列说法错误的是
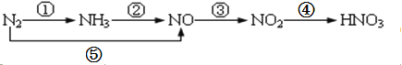
A.路线①②⑤均能表示氮的固定
B.路线②③④是工业生产硝酸的主要途径
C.路线⑤③④是“雷雨发庄稼”的主要途径
D.上述所有反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究反应具有重要意义。
(1)已知反应2H2(g)+O2(g)=2H2O(g)为放热反应,下图能正确表示该反应中能量变化的是_______ 。
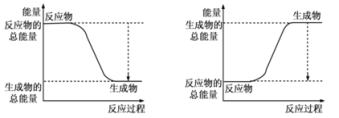
A B
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如上表:则生成1mol液态水可以放出热量____________kJ
(2)将质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,设计成原电池,负极材料是______________, 正极的反应式为______________,电解质溶液中SO42- 移向______极(填“正”或“负”)。
(3)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为______ ;X为______ 。若反应经2min时C的浓度______ 0.8mol/L(填“大于,小于或等于”)。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为______ ;X为______ 。若反应经2min时C的浓度______ 0.8mol/L(填“大于,小于或等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) 3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1
H2O(l) H2O(g) ΔH=+44.0 kJ·mol-1
则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为 。
(2)已知:TiO2(s)+2Cl2(g) TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示 ),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN
),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN![]() N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。
(4)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:
2H2+O2 2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将___________能转化为__________能。其电极反应式分别为:负极_________________,正极____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为_________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明溶液:A13+、NH4+、Cl-、S2-
B. 在含0.1 mol/LHClO溶液中:Cu2+、Fe2+、Cl-、SO42-
C. ![]() =1×10-13mol·L-1的溶液:Na+、K+、SiO32-、CO32-
=1×10-13mol·L-1的溶液:Na+、K+、SiO32-、CO32-
D. 在含0. 1mol/LFeCl3溶液中:K+、NH4+、I-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在做实验时引发了镁失火,他立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是
2MgO+C,下列关于该反应的判断正确的是
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性CO2>MgO,还原性Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于O原子得到的电子数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用。
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。
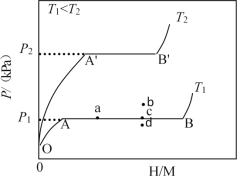
在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐惭增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g)=ZMHy(s)△H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(Ⅰ)中z=___(用含x和y的代数式表示)。温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=___mLg-1min。反应的焓变△H1__0(填“>”“<”或“=”)。
(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)____η(T2)(填“>”“<”或“=”)。当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的___点(填“b”“c”或“d”),该贮氢合金可通过___或___的方式释放氢气。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com