
����Ŀ���������ı仯�ͷ�Ӧ�Ŀ����ȽǶ��о���Ӧ������Ҫ���塣
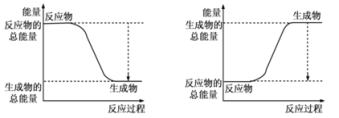
(1)��֪��Ӧ2H2��g��+O2��g��=2H2O��g��Ϊ���ȷ�Ӧ����ͼ����ȷ��ʾ�÷�Ӧ�������仯����_______ ��
A B
��ѧ�� | H��H | O��O | H��O |
����kJ/mol | 436 | 496 | 463 |
�Ӷϼ��ͳɼ��ĽǶȷ���������Ӧ�������ı仯����ѧ���ļ������ϱ���������1molҺ̬ˮ���Էų�����____________kJ
(2)��������ͬ��ͭ����п���õ������Ӻ����CuSO4��Һ�У���Ƴ�ԭ��أ�����������______________, �����ķ�ӦʽΪ______________���������Һ��SO42�� ����______�����������������
(3)һ���¶��£���3 molA�����1mol B����ͨ��һ�ݻ��̶�Ϊ2L���ܱ������У��������·�Ӧ��3A(g)��B(g) ![]() xC(g)����Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L����1min�ڣ�B��ƽ����Ӧ����Ϊ______ ��XΪ______ ������Ӧ��2minʱC��Ũ��______ 0.8mol/L������ڣ�С�ڻ���ڡ�����
xC(g)����Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L����1min�ڣ�B��ƽ����Ӧ����Ϊ______ ��XΪ______ ������Ӧ��2minʱC��Ũ��______ 0.8mol/L������ڣ�С�ڻ���ڡ�����
���𰸡�A 242 Zn Cu2����2e���� Cu �� 0.2mol/(L��min) 2 С��
��������
(1)��ͼ��֪��A�з�Ӧ����������������������������Ϊ���ȷ�Ӧ������2molH2�еĻ�ѧ������2��436kJ����������1molO2�еĻ�ѧ������496kJ������������2��436+496=1368kJ�������γ�4molHO���ͷ�4��463kJ=1852kJ������2molH2��������ȼ������2molˮ�ķ�Ӧ����H=��Ӧ���м���֮���������м���֮��=13682kJ/mol 1852kJ/mol=484kJ/mol����H2��������ȼ������1molˮ�ų�������Ϊ242kJ��
�ʴ�Ϊ��A��242��
(2)п�ϻ��ã�Ϊ��������������ͭΪ�����������Ϸ�����ԭ��Ӧ����ͭ��������ӦʽΪCu2++2e=Cu��
�ʴ�Ϊ��Zn��Cu2++2e=Cu������
(3)��Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L���μӷ�Ӧ��A�����ʵ���Ϊ3mol1.8mol=1.2mol���ɷ���ʽ��֪���μӷ�Ӧ��BΪ1.2mol��![]() =0.4mol����1min�ڣ�B��ƽ����Ӧ����Ϊ
=0.4mol����1min�ڣ�B��ƽ����Ӧ����Ϊ =0.2mol/(L��min)��
=0.2mol/(L��min)��
���ɵ�CΪ0.4mol/L��2L=0.8mol����1.2mol:0.8mol=3:x�����x=2��
���ŷ�Ӧ�Ľ��У���Ӧ������С������Ӧ��2min�ﵽƽ�⣬��1min��ƽ������С��ǰ1min��ƽ�����ʣ�ǰ1min��C��Ũ�ȱ仯Ϊ0.4mol/L�����1min��C��Ũ�ȱ仯С��0.4mol/L����ƽ��ʱC��Ũ��С��0.8mol/L��
�ʴ�Ϊ��0.2mol/(Lmin)��2��С�ڡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������0.2 mol�ơ�þ�����ֱ�Ͷ�뵽10 mL 1 mol��L��1�����У��ڱ�״���²�������������ɴ�С��˳����
A.V(Na)��V(Al)��V(Mg)B.V(Al)��V(Mg)��V(Na)
C.V(Al)��V(Mg)��V(Na)D.V(Na)��V(Al)��V(Mg)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����պ�����ҵ���ٷ�չ����ͭ�Ͻ�㷺���ں��չ�ҵ������ͭ�Ͻ��и�����л��������Ʊ�ͭ������Ʒ�Ĺ������£�

ע��A1(OH)3��Cu(OH)2�ֽ��¶ȷֱ�Ϊ450���80��
(1)�ڵ�⾫����ʱ����������Ϊ___________��
(2)�ӿ�����(��������)����ϡH2SO4���ʵĴ�ʩΪ___________(д������)��
(3)����A��ϡHNO3��Ӧ�������������ڿ�����Ѹ�ٱ�Ϊ����ɫ������A��ϡHNO3��Ӧ�����ӷ���ʽΪ______________________��
(4)���˲�����Ҫ�IJ����������ձ����___________��
(5)��������B�����Ϊ___________�������ɹ���B�Ĺ����У������NaOH�ļ���������NaOH�����������������ķ�Ӧ�����ӷ���ʽΪ___________��
(6)���ս�ͨ����������ԭ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����Ũ�Ⱦ�Ϊ0.1mol/L������ֱ�ΪVa��Vb��HA��Һ��BOH��Һ����ͬ����Ȼ�ϣ�����Va+Vb=100mL��Va��Vb����ҺpH�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
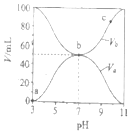
A.Ka(HA)=1��10-6mol/L
B.b��c(B+)=c(A-)=c(OH-)=c(H+)
C.c��ʱ��![]() ���¶����߶���С
���¶����߶���С
D.a��c������ˮ�ĵ���̶�ʼ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��![]() ��ˮ������EΪ���������ռ������������Ʒ�ɹ˪��E��һ�ֺϳ�·�����£�
��ˮ������EΪ���������ռ������������Ʒ�ɹ˪��E��һ�ֺϳ�·�����£�
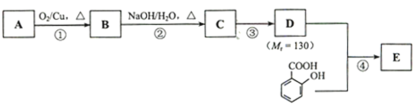
��ش��������⣺
��1��һԪ��A��������������ԼΪ21.6%����A�ķ���ʽΪ______���˴Ź�����������ʾ��A�������ֲ�ͬ��ѧ�������⣬�ҷ����֮��Ϊ3��2��2��2��1��A������Ϊ______��
��2��B����������Һ������Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ______��
��3��C��____�ֽṹ����һ��ȡ��������C�����������ţ���ʹ�õ��Ⱥ�˳��д�������Լ���___��
��4���ڢ۲��ķ�Ӧ����Ϊ______��D���������ŵ�����Ϊ_____��
��5��д��ͬʱ��������������ˮ��������ͬ���칹��Ľṹ��ʽ��______��
a����������6��̼ԭ����һ��ֱ���ϣ�
b�����������������Ű���ˮ������еĹ����ţ�
��6���ڢܲ��ķ�Ӧ����Ϊ______��д��E�Ľṹ��ʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и�������һ������ָ����Һ�д���������ǣ� ��
A. ʹ��̪���ɫ����Һ�У�Na����Al3����SO42����Cl��
B. ![]() =1��10��13mol��L��1����Һ�У�NH4����Ca2����Cl����NO3��
=1��10��13mol��L��1����Һ�У�NH4����Ca2����Cl����NO3��
C. ��Al��Ӧ�ܷų�H2����Һ�У�Fe2����K����NO3����SO42��
D. ˮ�����c(H��)=1��10��13mol��L��1����Һ�У�K����Na����AlO2����CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������240mL 1.00mol/L��H2SO4����Һ����ز����������㣻����ȡ����ϡ�͡���ȴ����ת�ơ�ϴ�ӣ������ݣ���ҡ�ȡ�
(1)����98%��Ũ���ᣨ�ܶ�ԼΪ1.8g/cm3�������ƣ�������Ͳ��ȡŨ��������Ϊ_______________��
(2)ʵ�������õ��IJ����������ձ�������������Ͳ��_______________��_______________��
(3)���в����л���������ϡ����Ũ��ƫ��IJ�����_______________��������ĸ��
A������Ͳ��ȡŨ����ʱ�����Ӷ���
B������Ͳ�е�����ȡ��Ũ�����ϴ����Ͳ�ڱڲ���ϴ��Һת������ƿ��
C��ϡ��Ũ����ʱ������Һ�彦��
D��Ũ����ϡ�ͺ�δ��ȴ������ת�Ƶ�����ƿ�� E������ƿ�в�������ˮ����������Һ
F������ҡ�Ⱥ���Һ����ڿ̶���
(4)������������Һʱ����ݶ���ʱ�IJ���_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����H2Sת��Ϊ�������õ���Դ����Դ�о��������Ҫ���⡣
��1��H2S��ת��
�� | ����˹�� |
|
�� | ���������� |
|
�� | ��ֽⷨ |
|
�� ��Ӧ��Ļ�ѧ����ʽ��________��
�� ��Ӧ��____+ 1 H2S ==____Fe2+ + ____S�� + ____������Ӧ������������
�� ��Ӧ��������H2S���ȶ�������H2O�����ԭ�ӽṹ���Ͷ����ȶ��Բ����ԭ��_______��
��2����Ӧ����IJ��ʵͣ���Ӧ���ԭ�������ʵ͡��ҹ�������Ա���뽫������Ӧ��ϣ�ʵ����H2S��Ч����S��H2������ת�ƹ�����ͼ��

���̼ס����У��������ֱ���______��
��3��������ƣ�������Ա�о����¡�
�� �����о��������Ƿ���У�װ����ͼ�������飬n����������Fe3+��p��������H2��n��������Fe3+�Ŀ���ԭ��

����Fe2+ - e- = Fe3+
����2H2O -4e-=O2 +4H+��_______��д���ӷ���ʽ������ȷ�ϣ����Dz���Fe3+��ԭ�����ҿ��С�
�� ���ղ���Fe3+����n����ע��H2S��Һ����S���ɣ���������������p������H2���о�S������ԭ���������ʵ�鷽����______�� ��ȷ�ϣ�S����Fe3+����H2S���ã�H2S����ֱ�ӷŵ硣���̼��С�
��4�����ϣ���Ӧ������ϣ�ͬʱ�ܸ�Ч����H2��S���乤��ԭ����ͼ��

��һ���о����֣�����Fe3+/Fe2+ �⣬I3-/I- Ҳ��ʵ����ͼ��ʾѭ�����̡���ϻ�ѧ���˵��I3-/I- �ܹ�ʹSԴԴ���ϲ�����ԭ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ��������������Ӧ�ù㷺�����з�Ӧ������������ԭ��Ӧ���ǣ� ��
A. ľ̿ȼ�գ�C + O2 ![]() CO2
CO2
B. ����̼��þ��MgCO3 ![]() MgO + CO2 ��
MgO + CO2 ��
C. ����ұ����Fe2O3��3CO![]() 2Fe��3CO2
2Fe��3CO2
D. ���ˮ��2H2O![]() 2 H2 �� + O2 ��
2 H2 �� + O2 ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com