
【题目】若将0.2 mol钠、镁、铝分别投入到10 mL 1 mol·L-1盐酸中,在标准状况下产生氢气的体积由大到小的顺序是
A.V(Na)=V(Al)=V(Mg)B.V(Al)>V(Mg)>V(Na)
C.V(Al)=V(Mg)>V(Na)D.V(Na)>V(Al)=V(Mg)
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】2020年3月24日,中国工程院院士、天津中医药大学校长张伯礼表示,中成药连花清瘟胶囊对于治疗轻型和普通型的新冠肺炎患者有确切的疗效。其有效成分绿原酸的结构简式如图,下列有关绿原酸说法正确的是
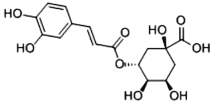
A.最多有 7 个碳原子共面
B.1mol 绿原酸可消耗 5molNaOH
C.不能使酸性高锰酸钾溶液褪色
D.能发生酯化、加成、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(9分)现有含NaCL、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现CL-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
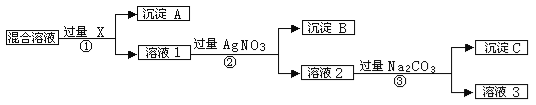
请回答下列问题:
⑴写出实验中下列物质的化学式:试剂X :_______,沉淀A:_______,沉淀B:______。
⑵上述实验流程中加入过量的Na2CO3的目的是___________________________________。
⑶按此实验方案得到的溶液3中肯定含有___________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________ ,之后若要获得固体NaNO3需进行的实验操作是________________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氨碱法(索氏)和联合制碱法(侯氏)对比分析,错误的是
A.产品完全相同B.生产NaHCO3的反应原理相同
C.食盐利用率不同D.都循环利用了CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯胺(NH2Cl,Cl的化合价为+1价)是一种长效缓释有机氯消毒剂,它与水可以发生复分解反应。有关氯胺的说法错误的是
A.氯胺中的氮元素为-3价
B.氯胺与水反应的产物为NH2OH和HCl
C.氯胺的消毒原理与漂粉精相似
D.氯胺的消毒效率(单位质量的消毒剂得到的电子数)是Cl2的1.38倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化镁(MgO2)不溶于水,与酸反应生成H2O2,在医学上可作解酸剂。常温下MgO2较稳定,加热时会分解生成O2和MgO。MgO与H2O2反应可制得MgO2,同时放出大量热。一种制备MgO2的流程如图所示:
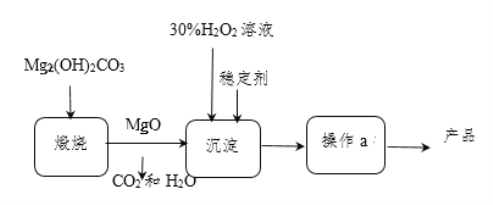
请回答下列问题:
(1)煅烧Mg2(OH)2CO3的化学反应方程式为_______________________;检验Mg2(OH)2CO3已分解完全的方法是______________________________。(写出实验操作和现象)
(2)上述制备过程中加入稳定剂的作用是___________;操作a为_____________。
MgO2产品中常会混有少量MgO,实验室可通过多种方案测定样品中MgO2的含量。某研究小组拟用下图装置测定样品(含MgO杂质)中MgO2的含量。
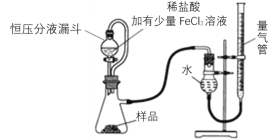
(3)研究小组的实验原理是(用化学方程式表示)①___________________________;
②2H2O2 → 2H2O +O2↑,稀盐酸中加入少量FeCl3溶液的作用是_______________。
(4)实验中使用恒压分液漏斗的优点是:使分液漏斗中的溶液顺利滴下、___________。
(5)反应结束后,先_________________,然后__________________,最后平视刻度线读数并记录。
(6)该小组记录的实验数据如下,样品的质量为m g;反应开始前量气管的读数为a mL;反应结束后量气管的读数为b mL,则样品中过氧化镁的质量分数为______(该实验条件下O2密度为ρ gL-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰碱性干电池是依据原电池原理制成的化学电源。电池中负极与电解质溶液接触直接反应会降低电池的能量转化效率,称为自放电现象。


下列关于原电池和干电池的说法不正确的是
A. 两者正极材料不同
B. MnO2的放电产物可能是KMnO4
C. 两者负极反应式均为Zn失电子
D. 原电池中Zn与稀H2SO4存在自放电现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究反应具有重要意义。
(1)已知反应2H2(g)+O2(g)=2H2O(g)为放热反应,下图能正确表示该反应中能量变化的是_______ 。
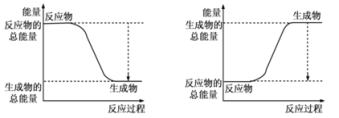
A B
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如上表:则生成1mol液态水可以放出热量____________kJ
(2)将质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,设计成原电池,负极材料是______________, 正极的反应式为______________,电解质溶液中SO42- 移向______极(填“正”或“负”)。
(3)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为______ ;X为______ 。若反应经2min时C的浓度______ 0.8mol/L(填“大于,小于或等于”)。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为______ ;X为______ 。若反应经2min时C的浓度______ 0.8mol/L(填“大于,小于或等于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com