
【题目】已知:![]() 。水杨酸酯E为紫外线吸收剂,可用于配制防晒霜。E的一种合成路线如下:
。水杨酸酯E为紫外线吸收剂,可用于配制防晒霜。E的一种合成路线如下:
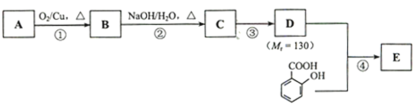
请回答下列问题:
(1)一元醇A中氧的质量分数约为21.6%,则A的分子式为______;核磁共振氢谱分析显示,A的有五种不同化学环境的氢,且峰面积之比为3:2:2:2:1。A的名称为______。
(2)B能与银氨溶液发生反应,该反应的化学方程式为______。
(3)C有____种结构;若一次取样,检验C中所含官能团,按使用的先后顺序写出所用试剂:___。
(4)第③步的反应类型为______;D所含官能团的名称为_____。
(5)写出同时符合下列条件的水杨酸所有同分异构体的结构简式:______。
a.分子中有6个碳原子在一条直线上;
b.分子中所含官能团包括水杨酸具有的官能团;
(6)第④步的反应条件为______;写出E的结构简式:______。
【答案】C4H10O 1-丁醇 CH3CH2CH2CHO+2Ag(NH3)2OH![]() CH3CH2CH2COONH4+2Ag↓+3NH3+H2O 2 银氨溶液、稀盐酸、溴水 还原反应(或加成反应) 羟基
CH3CH2CH2COONH4+2Ag↓+3NH3+H2O 2 银氨溶液、稀盐酸、溴水 还原反应(或加成反应) 羟基 ![]() 、
、![]() 、
、![]() 、
、![]() 浓硫酸、加热
浓硫酸、加热 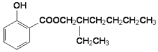
【解析】
(1)一元醇A中含有1个O原子,氧的质量分数约为21.6%,所以A的相对分子质量为16÷21.6%=74,所以分子式是C4H10O,A有五种不同化学环境的氢,且峰面积之比为3:2:2:2:1,则A的结构简式是CH3CH2CH2CH2OH;名称是1-丁醇;
(2)CH3CH2CH2CH2OH被催化氧化为CH3CH2CH2CHO,CH3CH2CH2CHO能与银氨溶液发生反应生成CH3CH2CH2COONH4、Ag、NH3、H2O,反应方程式是CH3CH2CH2CHO+2Ag(NH3)2OH![]() CH3CH2CH2COONH4+2Ag↓+3NH3+H2O;
CH3CH2CH2COONH4+2Ag↓+3NH3+H2O;
(3)结合题给信息可知C可能为:![]() 或
或![]() ,所以C有2种结构;同时含有醛基和碳碳双键,溴水能氧化醛基和碳碳双键,先用银氨溶液检验醛基,反应掉所有醛基后,加盐酸中和至酸性,再加溴水检验碳碳双键;
,所以C有2种结构;同时含有醛基和碳碳双键,溴水能氧化醛基和碳碳双键,先用银氨溶液检验醛基,反应掉所有醛基后,加盐酸中和至酸性,再加溴水检验碳碳双键;
(4)无论C是哪种结构与足量氢气发生反应均得到相对分子质量为130的醇CH3CH2CH2CH2CH(CH2OH)CH2CH3,D中含有的官能团是羟基;
(5)水杨酸的不饱和度是5,必须含有羧基和羟基,另外两个碳碳三键交替出现才能使6个碳原子共线,符合条件的结构简式有![]() 、
、![]() 、
、![]() 、
、![]() ;
;
(6)第④步反应为酯化反应,反应条件为浓硫酸、加热;CH3CH2CH2CH2CH(CH2OH)CH2CH3和![]() 发生酯化反应生成E,则E是
发生酯化反应生成E,则E是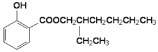 。
。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】对氨碱法(索氏)和联合制碱法(侯氏)对比分析,错误的是
A.产品完全相同B.生产NaHCO3的反应原理相同
C.食盐利用率不同D.都循环利用了CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种高效的杀菌消毒剂,也常用来漂白织物等。用下列装置探究NaClO2的制备。
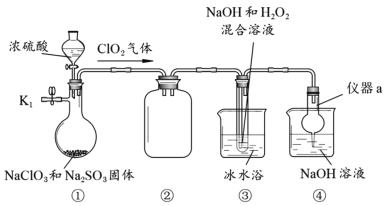
完成下列填空:
(1)仪器a的名称为__________,装置②的作用是________________。
(2)检查装置气密性的方法是________________________________________________。
(3)关闭K1,从分液漏斗中加入一定量浓硫酸,装置③中生成NaClO2的化学方程式为2ClO2+2NaOH+H2O2→2NaClO2+2H2O+O2↑,该反应的氧化产物是_____________。
(4)实验完成后,为防止装置中残留的有毒气体污染空气,可以进行的操作是:打开止水夹K1,____________________________________________。
(5)从装置③的溶液中获得NaClO2晶体的主要操作有减压蒸发浓缩、________________、过滤洗涤、干燥等。
(6)晶体以NaClO2·3H2O的形式存在,已知:NaClO2·3H2O![]() NaCl+O2↑+3H2O↑。为测定所得固体中NaClO2·3H2O的质量分数,在收集到足量的晶体后,进行如下实验:取样品质量为a g,灼烧恒重后,得到固体b g。则晶体中NaClO2·3H2O的质量分数是__________。
NaCl+O2↑+3H2O↑。为测定所得固体中NaClO2·3H2O的质量分数,在收集到足量的晶体后,进行如下实验:取样品质量为a g,灼烧恒重后,得到固体b g。则晶体中NaClO2·3H2O的质量分数是__________。
若发生副反应4[NaClO2·3H2O]![]() 2NaCl+2NaClO3+O2↑+12H2O↑,则实验测得的值会__________。(选填“偏大”、“偏小”或“不变”)
2NaCl+2NaClO3+O2↑+12H2O↑,则实验测得的值会__________。(选填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有氮及其化合物的转化关系如下图,则下列说法错误的是
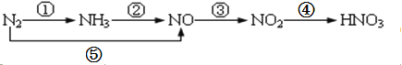
A.路线①②⑤均能表示氮的固定
B.路线②③④是工业生产硝酸的主要途径
C.路线⑤③④是“雷雨发庄稼”的主要途径
D.上述所有反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的装置中,烧瓶中充满干燥气体a,然后打开弹簧夹f,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,烧瓶中的液体d呈喷泉喷出,最终几乎充满烧瓶。下列各组不可能出现上述现象的是
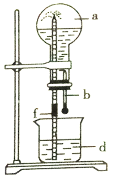
序号 | a(干燥气体) | b(液体)与d(液体) |
A | NO | 水 |
B | CO2 | 4mol·L-1NaOH溶液 |
C | Cl2 | 4mol·L-1NaOH溶液 |
D | NH3 | 1mol·L-1盐酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究反应具有重要意义。
(1)已知反应2H2(g)+O2(g)=2H2O(g)为放热反应,下图能正确表示该反应中能量变化的是_______ 。
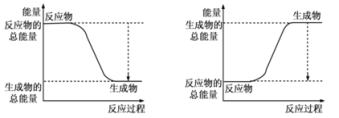
A B
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如上表:则生成1mol液态水可以放出热量____________kJ
(2)将质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,设计成原电池,负极材料是______________, 正极的反应式为______________,电解质溶液中SO42- 移向______极(填“正”或“负”)。
(3)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为______ ;X为______ 。若反应经2min时C的浓度______ 0.8mol/L(填“大于,小于或等于”)。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为______ ;X为______ 。若反应经2min时C的浓度______ 0.8mol/L(填“大于,小于或等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) 3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1
H2O(l) H2O(g) ΔH=+44.0 kJ·mol-1
则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为 。
(2)已知:TiO2(s)+2Cl2(g) TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示 ),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN
),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN![]() N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。
(4)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:
2H2+O2 2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将___________能转化为__________能。其电极反应式分别为:负极_________________,正极____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明溶液:A13+、NH4+、Cl-、S2-
B. 在含0.1 mol/LHClO溶液中:Cu2+、Fe2+、Cl-、SO42-
C. ![]() =1×10-13mol·L-1的溶液:Na+、K+、SiO32-、CO32-
=1×10-13mol·L-1的溶液:Na+、K+、SiO32-、CO32-
D. 在含0. 1mol/LFeCl3溶液中:K+、NH4+、I-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.![]() 离子中心原子上的孤电子对数是1,立体构型为平面三角形
离子中心原子上的孤电子对数是1,立体构型为平面三角形
B.元素周期表第三周期主族元素中,简单离子半径最小的是![]()
C.金刚石转化为石墨为放热反应,说明相同条件下石墨比金刚石稳定
D.![]() 、
、![]() 都是非极性分子
都是非极性分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com