
【题目】现有氮及其化合物的转化关系如下图,则下列说法错误的是
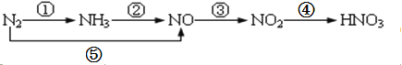
A.路线①②⑤均能表示氮的固定
B.路线②③④是工业生产硝酸的主要途径
C.路线⑤③④是“雷雨发庄稼”的主要途径
D.上述所有反应都是氧化还原反应
【答案】A
【解析】
A. 氮的固定是指游离态的氮元素转化为化合态氮,即由氮气生成氮的化合物,路线中①⑤能表示氮的固定,故A错误;
B. 工业生产硝酸是由氨气催化氧化生成NO,NO再氧化生成NO2,然后与水反应生成硝酸,即主要途径是②③④,故B正确;
C. 雷雨发庄稼的原理是氮气与氧气在放电的条件下反应生成NO,NO与空气中氧气反应生成NO2,降雨时NO2与水反应生成硝酸,硝酸和土壤里的矿物质结合成为硝酸盐,被植物吸收,路线为⑤③④,故C正确;
D. N2中N元素为0价,NO中N元素为+2价,NO2中N元素为+4价,NH3中N元素为-3价,HNO3中N元素为+5价,所以上述反应中都有元素化合价变化,都是氧化还原反应,故D正确;
故选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】由乙烯和其它无机原料合成环状化合物E,请在下列图信回答下列问题:
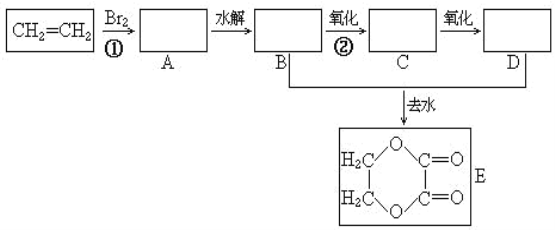
(1)写出①的反应类型______,②所需添加的试剂和反应条件_______
(2)B的结构简式______
(3)E与氢氧化钠溶液反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其它杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如图流程:

已知:某些金属阳离子可以通过“控制pH”[即调节溶液的酸碱性,pH=-lgc(H+), pH值越大,碱性越强]使其转化为沉淀。固体2为白色沉淀。
(1)加足量酸之后的实验操作是______________________。
(2)溶解烧渣选用的足量酸能否是盐酸,并说明理由___________________________。
(3)验证溶液2中是否含有Fe3+的方法:_______________________________________。
(4)试剂X的作用是_________________。
(5)从溶液2中得到绿矾的操作步骤为:______________、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有________________。(此空填序号)
A.蒸发皿 B.石棉网 C.烧杯 D.玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国航空航天事业飞速发展,银铜合金广泛用于航空工业。从银铜合金切割废料中回收银并制备铜化工产品的工艺如下:

注:A1(OH)3和Cu(OH)2分解温度分别为450℃和80℃
(1)在电解精炼银时,阳极材料为___________。
(2)加快渣料(含少量银)溶于稀H2SO4速率的措施为___________(写出两种)。
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为______________________。
(4)过滤操作需要的玻璃仪器除烧杯外还有___________。
(5)固体混合物B的组成为___________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为___________。
(6)煅烧阶段通入惰性气体的原因___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.把5.1g镁铝合金的粉末放入足量的氢氧化钠溶液中,得到2.24LH2(标准状况下测定)。
(1)合金中镁的质量为________。
(2)写出该合金溶于足量的氢氧化钠溶液的化学方程式:_________________________。
Ⅱ. 在AlCl3和MgCl2的混合溶液中逐滴加入氢氧化钠溶液,生成沉淀的物质的量与加入氢氧化钠的物质的量的关系如图所示。
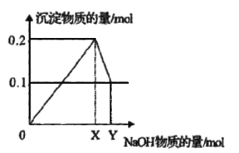
(3)在混合溶液中AlCl3和MgCl2的物质的量之比为_____________。
(4)写出XY段发生反应的离子方程式_____________________________。
(5)X=____________;Y=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是( )
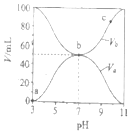
A.Ka(HA)=1×10-6mol/L
B.b点c(B+)=c(A-)=c(OH-)=c(H+)
C.c点时,![]() 随温度升高而减小
随温度升高而减小
D.a→c过程中水的电离程度始终增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 。水杨酸酯E为紫外线吸收剂,可用于配制防晒霜。E的一种合成路线如下:
。水杨酸酯E为紫外线吸收剂,可用于配制防晒霜。E的一种合成路线如下:
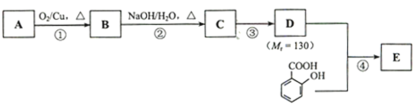
请回答下列问题:
(1)一元醇A中氧的质量分数约为21.6%,则A的分子式为______;核磁共振氢谱分析显示,A的有五种不同化学环境的氢,且峰面积之比为3:2:2:2:1。A的名称为______。
(2)B能与银氨溶液发生反应,该反应的化学方程式为______。
(3)C有____种结构;若一次取样,检验C中所含官能团,按使用的先后顺序写出所用试剂:___。
(4)第③步的反应类型为______;D所含官能团的名称为_____。
(5)写出同时符合下列条件的水杨酸所有同分异构体的结构简式:______。
a.分子中有6个碳原子在一条直线上;
b.分子中所含官能团包括水杨酸具有的官能团;
(6)第④步的反应条件为______;写出E的结构简式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制240mL 1.00mol/L的H2SO4标准溶液的相关操作:①计算;②量取;③稀释、冷却;④转移、洗涤;⑤定容;⑥摇匀。
(1)现用98%的浓硫酸(密度约为1.8g/cm3)来配制,需用量筒量取浓硫酸的体积为_______________。
(2)实验中所用到的玻璃仪器有烧杯、玻璃棒、量筒、_______________、_______________。
(3)下列操作中会引起所配稀硫酸浓度偏大的操作有_______________。(填字母)
A.用量筒量取浓硫酸时,俯视读数
B.从量筒中倒出量取的浓硫酸后洗涤量筒内壁并把洗涤液转入容量瓶中
C.稀释浓硫酸时有少量液体溅出
D.浓硫酸稀释后未冷却就立即转移到容量瓶中 E.容量瓶中残留少量水即用来配溶液
F.定容摇匀后,发现液面低于刻度线
(4)简述上述配溶液时步骤⑤定容时的操作_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com