
【题目】
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。

【答案】 A N 球形 K的原子半径较大且价电子数较少,金属键较弱 V形 sp3 0.315 12 体心 棱心
【解析】(1)紫色波长400nm~435nm,因此选项A正确;(2)K位于第四周期IA族,电子占据最高能层是第四层,即N层,最后一个电子填充子在s能级上,电子云轮廓图为球形;K的原子半径大于Cr的半径,且价电子数较少,金属键较弱,因此K的熔点、沸点比Cr低;(3)I3+与OF2互为等电子体,OF2属于V型,因此I3+几何构型为V型,其中心原子的杂化类型为sp3;(4)根据晶胞结构,K与O间的最短距离是面对角线的一半,即为![]() nm=0.315nm,根据晶胞的结构,距离K最近的O的个数为12个;(5)根据KIO3的化学式,以及晶胞结构,K处于体心,O处于棱心。
nm=0.315nm,根据晶胞的结构,距离K最近的O的个数为12个;(5)根据KIO3的化学式,以及晶胞结构,K处于体心,O处于棱心。


科目:高中化学 来源: 题型:
【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是1 L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g ·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.158 | 158 |
硝酸银 | 0.04 | 170 |
⑴下列“鲜花保鲜剂”的成分中,属于非电解质的是_______。
A、蔗糖 B、硫酸钾 C、高锰酸钾 D、硝酸银
⑵“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为___________molL-1。
⑶配制上述1 L“鲜花保鲜剂”所需的仪器有:烧杯、玻璃棒、药匙、____________、__________、________________。(在横线上填写所缺仪器的名称)
⑷在溶液配制过程中,下列操作正确且对配制结果没有影响的是__________。
A.将药品放入容量瓶中加蒸馏水溶解
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的说法中正确的是( )
A. 苯分子中的所有化学键都完全相同
B. 苯分子中含有碳碳双键,能使酸性高锰酸钾溶液褪色
C. 苯是一种密度比水小,不溶于水的有特殊气味的无色液体
D. 在催化剂存在下,苯能与溴水发生取代反应,生成溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Ba2+、Fe3+、C1-、SO42-、CO32-,将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
序号 | 实验内容 | 实验结果 |
1 | 加过量盐酸 | 无气体产生 |
2 | 加足量NaOH溶液并加热 | 收集到气体2.24 L(标准状况),并有红褐色沉淀生成,将沉淀过滤洗涤、干燥、灼烧至质量不再变化,称重得1.60 g固体。 |
3 | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量 | 称量读数为2.33g |
试确定溶液中一定存在的离子及其物质的量浓度(可不填满):
离子符号 | 物质的量浓度(mol·L-1) |
_____ | _____ |
_____ | _____ |
_____ | _____ |
_____ | _____ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二铟(In2O3)是一种透明的导电材料,可运用于接触屏、液晶显示器等高科技领域;铟产业被称为“信息时代的朝阳产业”。利用水铟矿[主要成分In(OH)3,常温下Ksp[In(OH)3]=l.41×10-33]制备In2O3的工艺流程如下:

(1)写出水铟矿被硫酸酸浸的离子方程式_____________________________。
(2)从硫酸铟溶液中制备硫酸铟晶体的实验步骤:________、_______、过滤、洗涤、干燥。
(3)某研究机构用硫酸提取铟时,酸度(每升溶液中含硫酸的质量)与浸出率关系如图

①当酸度为196时,硫酸物质的量浓度为______________。
②请选择适宜的酸度值:___________,并说明选择的理由____________。
(4)完成下列方程式:
(_____)In(NO3)3![]() (_____)In2O3+(_____) _______↑+(_____) _______↑
(_____)In2O3+(_____) _______↑+(_____) _______↑
(5)高纯铟与浓硝酸反应过程中产生的NO2气体可被过氧化钠直接吸收,则标准状况下448mlNO2可被______gNa2O2吸收,NO2的排放会引起一系列的环境问题,任写一条其引起的环境问题___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得
是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得![]() :
:![]()
![]()
![]() ,下列说法中正确的是( )
,下列说法中正确的是( )
A. ![]() 在反应中是还原剂
在反应中是还原剂
B. ![]() 参加反应,在标准状况下能得到22.4L气体
参加反应,在标准状况下能得到22.4L气体
C. 在反应中![]() 既不是氧化剂也不是还原剂
既不是氧化剂也不是还原剂
D. ![]() 参加反应有
参加反应有![]() 电子转移
电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应方程式:2NO2+2NaOH===NaNO3+NaNO2+H2O;NO2+NO+2NaOH===2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液的物质的量浓度为
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用固体NaOH配制0.5 mol/L的NaOH溶液500 mL,①烧杯②100 ml量筒③容量瓶④药匙⑤玻璃棒⑥托盘天平⑦烧瓶
(1)配制时,必须使用的仪器有_____________(填代号),还缺少的仪器是__________________。
(2)在配制的转移过程中某学生进行如图操作,请指出其中的错误:______________、____________。
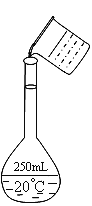
(3)配制时,一般可分为以下几个步骤①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为_________________。
(4)下列操作会使配制的溶液浓度偏低的是___________(填字母)
A.没有将洗涤液转移到容量瓶 B.转移过程中有少量溶液溅出
C.容量瓶洗净后未干燥 D.定容时俯视刻度线
E.固体NaOH中含有少量Na2O杂质
(5)在容量瓶使用方法中,下列操作不正确的是(填序号) ___________
A.使用容量瓶前检査它是否漏水
B.容量瓶用蒸馏水洗净后,再用碱液润洗
C.将氢氧化钠固体直接放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com