
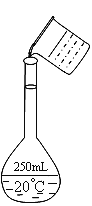
����Ŀ��ʵ�����ù���NaOH����0.5 mol/L��NaOH��Һ500 mL�����ձ���100 ml��Ͳ������ƿ��ҩ�עݲ�������������ƽ����ƿ
��1������ʱ������ʹ�õ�������_____________(�����)����ȱ�ٵ�������__________________��
��2�������Ƶ�ת�ƹ�����ijѧ��������ͼ��������ָ�����еĴ���______________��____________��
��3������ʱ��һ��ɷ�Ϊ���¼�������ٳ����ڼ�����ܽ��ҡ�Ȣ�ת�Ƣ�ϴ�Ӣ߶��ݢ���ȴ������ȷ�IJ���˳��Ϊ_________________��
��4�����в�����ʹ���Ƶ���ҺŨ��ƫ�͵���___________(����ĸ)
A.û�н�ϴ��Һת�Ƶ�����ƿ B.ת�ƹ�������������Һ����
C.����ƿϴ����δ���� D.����ʱ���ӿ̶���
E.����NaOH�������Na2O����
��5��������ƿʹ�÷����У����в�������ȷ����(�����) ___________
A.ʹ������ƿǰ������Ƿ�©ˮ
B.����ƿ������ˮϴ�������ü�Һ��ϴ
C.���������ƹ���ֱ�ӷ�����ƽ���̵���ֽ�ϣ�ȷ�����������ձ����ܽ������ע������ƿ��
D.���ݺ�����ƿ������ʳָ��סƿ��������һֻ�ֵ���ָ��סƿ�ף�������ƿ��תҡ��
���𰸡� �٢ۢܢݢ� ��ͷ�ι� δ�ò��������� ʹ����250mL������ƿ����ûʹ��500mL������ƿ�� �ڢ٢ۢ�ݢޢߢ����ڢ٢ۢ�ݢޢܢߢ� AB BC
����������1�����������м��㡢�������ܽ⡢��Һ��ϴ����Һ�����ݡ�ҡ�ȵȲ�����һ����������ƽ��������ҩ��ȡ��ҩƷ�����ձ����ܽ⣬���ò��������裬�����ܽ⣬��ȴ��ת�Ƶ�100mL����ƿ�У����ò�����������ϴ���ձ���������2-3�Σ�����ϴ��Һ��������ƿ�У���ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�����ݵߵ�ҡ�ȣ�������Ҫ�������У���ƽ���ձ�����������500mL����ƿ����ͷ�ιܡ�ҩ�ס�����ʱ������ʹ�õ��������٢ۢܢݢ�(�����)����ȱ�ٵ������ǽ�ͷ�ι�����2������NaOH��Һ500mL��Ҫ��500mL����ƿ��������ƿ����Һ��Ҫ�ò�������������3������ʱ��һ��ɷ�Ϊ���¼�������ٳ����ڼ�����ܽ��ҡ�Ȣ�ת�Ƣ�ϴ�Ӣ߶��ݢ���ȴ������ȷ�IJ���˳��Ϊ�ڢ٢ۢ�ݢޢߢ����ڢ٢ۢ�ݢޢܢߢ� ����4��A��û�н�ϴ��Һת�Ƶ�����ƿ������ת�Ƶ�����ƿ�����ʵ����ʵ���ƫС������Ũ�ȹ�ʽ��֪��������ҺŨ��ƫ�ͣ���A��ȷ��B��ת�ƹ�������������Һ����������ת�Ƶ�����ƿ�����ʵ����ʵ���ƫС������Ũ�ȹ�ʽ��֪��������ҺŨ��ƫ�ͣ���B��ȷ��C������ʱ����������ƿ�м���ˮ����������ƿϴ����δ�����ʵ����Ӱ�죬��C���� D������ʱ���ӿ̶��ߣ������¼��������ˮƫ�٣���Һ�����ƫС������Ũ�ȹ�ʽ��֪��������ҺŨ��ƫ�ߣ���D����E������NaOH�к�������Na2O���ʣ�Na2O��ˮ��Ӧ����NaOH��ʹNaOH�����ʵ���ƫ�࣬����Ũ�ȹ�ʽ��֪��������ҺŨ��ƫ�ߣ���E����ѡAB����5��A����������跴���ߵ�ҡ�ȣ���ʹ������ƿǰ������Ƿ�©ˮ����A��ȷ��B������ƿ������ˮϴ�������ü�Һ��ϴ����ʹ������ҺŨ��ƫ�ߣ���B����C�����������ܽ�ʱ�ų��������ȣ���ȴ����������Һ�����ƫС��������ƿ���Ȳ��������ܵ������ѣ�����������ƿ���ܽ��������ƣ���C����D��ҡ��ʱʳָ��סƿ��������һֻ�ֵ���ָ��סƿ�ף�������ƿ��ת��������ҡ�ȣ���D��ȷ����ѡBC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
�غ͵����ػ������ڻ�����ҽҩ�����ϵ��������Ź㷺��Ӧ�á��ش��������⣺
��1��Ԫ��K����ɫ��Ӧ���Ϻ�ɫ��������ɫ��Ӧ�ķ��䲨��Ϊ_______nm�����ţ���
A��404.4 B��553.5 C��589.2 D��670.8 E.766.5
��2����̬Kԭ���У��������ռ�ݵ�����ܲ�ķ�����_________��ռ�ݸ��ܲ���ӵĵ���������ͼ��״Ϊ___________��K��Cr����ͬһ���ڣ��Һ����������ӹ�����ͬ��������K���۵㡢�е�ȶ��Ƚ���Cr�ͣ�ԭ����___________________________��
��3��X��������ⶨ�ȷ��֣�I3AsF6�д���I3+���ӡ�I3+���ӵļ��ι���Ϊ_____________������ԭ�ӵ��ӻ���ʽΪ________________��
��4��KIO3������һ���������õķ����Թ�ѧ���ϣ����и��ѿ��͵�����ṹ���߳�Ϊa=0.446nm��������K��I��O�ֱ��ڶ��ǡ����ġ�����λ�ã���ͼ��ʾ��K��O�����̾���Ϊ______nm����K���ڵ�O����Ϊ__________��
��5����KIO3�����ṹ����һ�ֱ�ʾ�У�I���ڸ�����λ�ã���K����______λ�ã�O����______λ�á�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⡣
��1�����������ܵ��������ڵ���ʵ���________(�����)��
A. ��̬�Ȼ�þ(MgCl2) B. Һ̬�Ȼ�þ(MgCl2)
C. �Ȼ�����ҺD. ��
��2��д������������ˮ��Һ�еĵ��뷽��ʽ:
��Na2CO3______________��
��H2SO4______________��
��KHSO4_____________��
��3������˵�ɽ���������KHSO4��NaHCO3��Ϊͬһ���,����Ϊ����������Ҫ��_____������˵�ɽ���������KHSO4��H2SO4��Ϊͬһ���,����Ϊ����������Ҫ��_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������Ҵ���Ũ������»ᷢ�����з�Ӧ��

CH3CH2OH��CH3COOH![]() CH3COOCH2CH3��H2O
CH3COOCH2CH3��H2O
CH3CH2OH��CH3CH2OH![]() CH3CH2OCH2CH3��H2O
CH3CH2OCH2CH3��H2O
CH3CH2OH![]() CH2===CH2����H2O
CH2===CH2����H2O
�е㣺�Ҵ�78.5 �桢����117.9 �桢��������77.1 ��
ijͬѧΪ����ʵ�����Ʊ��������������������ͼ��ʾ��װ��(�����������ʡ��)��
ʵ�鲽�裺
���ڸ����100 mL������ƿ�м���8 mL 95%���Ҵ�������ˮ��ȴ�£���ҡ����������8 mLŨ���ᣬ�������Ƭ���ڵ�Һ©���м���8 mL 95%���Ҵ���8 mL���ᣬҡ�ȡ���ͼ��װ��������Һ©����ĩ�˺��¶ȼƵ�ˮ����������Һ�����¾�ƿ��0.5 cm��1 cm����
���õ���������ƿ�����¶ȼƶ���������110 ��ʱ���ӵ�Һ©���еμ��Ҵ���������Һ(�ٶ�Ϊÿ����30��Ϊ��)����ά�����˵ķ�Ӧ�¶ȡ��μ���ϣ��������������ӣ�ֱ����ӦҺ�¶�����130 �棬���������ҺΪֹ��
��ϴ�Ӵֲ��
��ش��������⣺
(1)���Ƭ��������_____________________________________________��
�����ܵ�������________________________________��ˮҪ��______(�A����B��)�ڽ��롣���Һ�ijɷ���_______________________________��
(2)����ʵ�����Ҫ�ϸ�����¶���________�����ң������________________��
(3)ϴ�Ӵֲ���ķ����ǣ���ֲ�������������________��Һ��Ȼ���÷�Һ�����롣�����йط�Һ������������ȷ����________(����ĸ���)��
a��Ӧѡ�����η�Һ©�����з�Һ��ʹ��ǰҪ����Ƿ�©ˮ
b�������Һ�����Һ©����������������������
c�����Һҡ�Ⱥ���������Һ©��������Ȧ�Ͼ��ã��ֲ�
d����Һ©���IJ��������ٴ�������ʹ�²�Һ��ӷ�Һ©���¶˷ų������²�Һ����ȫ������ر����������ϲ�Һ��ӷ�Һ©���Ͽڵ���
(4)Ϊ�˵õ������IJ������(3)�еõ������м�����ˮ����þ���и��Ȼ��ͨ��________�����롣
������������������Ʒ�ʹ�Ʒ�ķ���������������______________��
a������ˮ���� b���ý����Ƽ���
c���ⶨ�е� d��������Cu(OH)2����Һ����
(5)��ʵ����δ�������ʹ������Ӧ�����������﷽����У�(�����������)
��________________________________________________________��
��________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. ͬ��ͬѹ�£���ͬ����IJ�ͬ���ʣ����������������
B. �κ������£�������ļ���͵��������ķ������������
C. 1Lһ����̼����һ����1L����������С
D. ������̼�������Ļ�����壬��ƽ����Է�������Ϊ29����һ����̼����������������Ϊ3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ˮ������������Na2S2O3����������ˮ�����ȵIJⶨ���ⶨ����ˮ�����Ⱥ����ķ������£���250 mL����ƿ��(�������ƿ��)����0.5 g�⻯�أ���10 mLϡ���ᣬȷ��ȡ����ˮ��100 mL(������ˮ��ͷ����ˮ����ʮ�����ȡˮ��) ���ڵ���ƿ��Ѹ��������ҡ������ˮ���ʵ���ɫ����1 mL������Һ��������˵��ˮ���������ȡ�����c mol��L��1��Na2S2O3��Һ�ζ�������Һ��ɫ��ʧ����ɫ����Һ���������������������Һ�������
(��֪���ζ�ʱ��Ӧ�Ļ�ѧ����ʽΪI2��2Na2S2O3===2NaI��Na2S4O6)
(1)��������ˮ����Ư����������˵��ˮ���������ȵķ�Ӧ���ӷ���ʽΪ_______________________________________________________��
(2)����������ʵ�飬���ı�Na2S2O3��ҺV mL���ô�ʵ��������ˮ��Ʒ��������(������Cl2����)Ϊ________mg��L��1��������ʵ������У�����������ҡ������������Ѹ�٣����ý��________(�ƫ�ߡ�����ƫ�͡����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȼ��⾫�Ƶı���ʳ��ˮ�����õ���Ʒ����ȡƯ�۵ȡ�
��1����������к���SO42��������ʱ�������Լ���ȥSO42�������Լ�����ѡ��______��
A��Ba��OH��2 �� B��Ba��NO3��2 �� C��BaCl2
��2����ⱥ��ʳ��ˮ�����Ļ�ѧ����ʽ_________________��
��3����������������������Һ��ȡ��84������Һ�Ļ�ѧ����ʽ____________��
��4��Ư���ڿ����о��ú����ʵĻ�ѧ����ʽ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���۵����Ų�ʽΪ5s25p1��Ԫ�أ������ڱ��е�λ��
A. ��4���ڵ�IA�� B. ��4���ڢ�A��
C. ��5���ڢ�A�� D. ��5���ڢ�A��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���Ӻ���6�����ӡ�7������,�ʵ�����,������ԭ�ӷ��ſ�����
A. 13Al B. 13Al C. 13C D. 13C
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com