
铜在自然界存在于多种矿石中,如:
| 矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 | CuFeS2 | Cu5FeS4 | Cu2S | CuCO3·Cu(OH)2 |
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是______________。
(2)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是________________。
6Cu+SO2↑,反应的氧化剂是________________。
(3)SO2尾气直接排放到大气中造成环境污染的后果是_______________;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称_________________。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的原理:___________________________________。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是________(填字母)。
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铜绿的主要成分是碱式碳酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ对;有 |
| B | 铜表面易形成致密的氧化膜 | 铜容器可以盛放浓硫酸 | Ⅰ对;Ⅱ对;有 |
| C | 铁比铜活泼 | 铆在铜板上的铁钉在潮湿空气中不易生锈 | Ⅰ对;Ⅱ对;有 |
| D. | 蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 | 硫酸铜溶液可用作游泳池的消毒剂 | Ⅰ错;Ⅱ对;无 |
【答案】
(1)Cu2S
(2)Cu2O、Cu2S
(3)形成酸雨 硫酸,硫酸铵
(4)电解池中,粗铜作阳极,精铜作阴极,电解质为硫酸铜溶液。阳极上发生氧化反应,Cu失去电子,使Cu单质变为Cu2+进入溶液中Cu-2e- Cu2+;阴极上发生还原反应,Cu2+得到电子在阴极上析出Cu单质,Cu2++2e-
Cu2+;阴极上发生还原反应,Cu2+得到电子在阴极上析出Cu单质,Cu2++2e- Cu,从而达到精制Cu的目的
Cu,从而达到精制Cu的目的
(5)AD
【解析】(1)铜的质量百分含量:CuFeS2(34.8%) Cu5FeS4(63.5%) Cu2S(80%) CuCO3·Cu(OH)2(57.6%)。
(2)Cu2O、Cu2S的Cu由+1被还原为0价,作氧化剂;Cu2S的S有-2价被氧化为+4价,作还原剂。
(3)处理SO2尾气一般为循环制备硫酸,和用氨水吸收,最后可得到(NH4)2SO4等有价值的化学品。
(5)稀盐酸可以同Cu(OH)2与CuCO3反应,而且稀盐酸不能与Cu反应。所以稀盐酸可以除铜器表面的铜绿〔CuCO3·Cu(OH2)〕,A正确。
铜表面不能形成致密氧化膜;铜和浓硫酸在常温下是反应的,生成硫酸铜、SO2和水,反应很慢,反应过程中放热,随着反应的进行,速率会越来越快的,所以不能用铜制容器装浓硫酸,B错误。因为Fe比Cu活泼,所以Fe-Cu形成的原电池中,Fe作负极,更容易被氧化生锈,C错误。蓝色硫酸铜晶体受热转化为白色硫酸铜粉末,有新物质生成,属于化学变化;CuSO4可用作消毒剂,但与前者没有因果关系,D正确。
综上所述,答案选A、D。


科目:高中化学 来源: 题型:
下列关于电化学的实验事实正确的是
|
| 出现环境 | 实验事实 |
| A. | 以稀H2SO4为电解质的Cu-Zn原电池 | Cu为正极,正极上发生还原反应 |
| B. | 电解CuCl2溶液 |
|
| C. | 弱酸性环境下钢铁腐蚀 | 负极处产生H2,正极处吸收O2 |
| D. | 将钢闸门与外加电源负极相连 | 牺牲阳极阴极保护法,可防止钢闸门腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验“操作和现象”与“结论”对应关系正确的是
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成。 | 淀粉没有水解成葡萄糖 |
| C | 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去 。 | 使溶液褪色的气体是乙烯 |
| D | 向饱和Na2CO3中通入足量CO2 ,溶液变浑浊 | 析出了NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
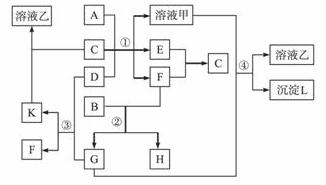
(1)A、B、C、D代表的物质分别为__________、__________、__________、__________(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是______________________________;
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是________、_________(填化学式);
(4)反应③产物中K的化学式为____________________;
(5)反应④的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于下列常见化学物质的认识错误的是( )
A.明矾可用作净水剂
B.干冰能用于人工降雨
C.碳酸钙是文物陶瓷的主要成分
D.小苏打是一种膨松剂,可用于制作馒头和面包
查看答案和解析>>
科目:高中化学 来源: 题型:
某学习小组用下图装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
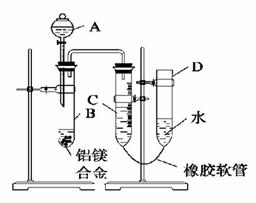
(1)A中试剂为______________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是____________________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性。上述操作的顺序是___________;(填序号)记录C的液面位置时,除视线平视外,还应_______________。
(4)B中发生反应的化学方程式为_________________________________________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为_______________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________(填“偏大”、“偏小”、“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关生铁炼钢的叙述错误的是
A. 添加必要的元素,改善钢材的组织结构和性能
B. 适当降低生铁中的含碳量,除去大部分硫、磷等杂质
C. 加入硅、锰、铝等合金元素调整成分并脱去钢水中的氧
D.除去生铁中的非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:
(1)Y的最高价氧化物对应水化物的化学式是______________。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是___________________,此液体具有的性质是______(填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生 成
成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为________。
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是_______________________________。
mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
从下列各组反应对比中,判断哪种粒子的氧化性最强,哪种粒子的还原性最强。
(1)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质。则在Cu、Fe、Ag中,________的还原性最强;在Cu2+、Fe2+、Ag+中,________的氧化性最强。
(2)铁钉在氯气中被锈蚀为棕褐色物质(FeCl3),而在盐酸中生成淡绿色溶液(FeCl2)。则在氯气分子(Cl2)、氯离子、氢离子中,________具有氧化性,________的氧化性最强。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com