
下列有关生铁炼钢的叙述错误的是
A. 添加必要的元素,改善钢材的组织结构和性能
B. 适当降低生铁中的含碳量,除去大部分硫、磷等杂质
C. 加入硅、锰、铝等合金元素调整成分并脱去钢水中的氧
D.除去生铁中的非金属元素
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
已知:I2+2S2O32-=S4O62-+2I-。相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,加入________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_____________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体。
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是_______________________________________________________(用化学方程式表示)。
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I―发生反应的氧化性质杂质)的纯度,过程如下:取 0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用___________作滴定指示剂,滴定终点的现象是_________________。
②CuCl2溶液与KI反应的离子方程式为______________________________。
③该试样中CuCl2•2H2O的质量百分数为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组拟选用如下装置制备氢化钙。
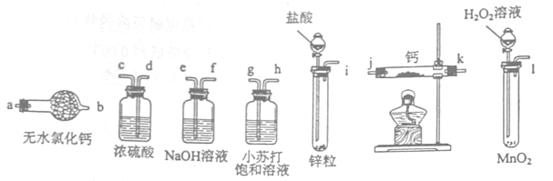
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为________(填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;_________(请按正确的顺序填入下列步骤的标号)。
A.加热反应一段时间 B.收集气体并检验其纯度
C.关闭分液漏斗活塞 D.停止加热,充分冷却
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此断,上述实验确有CaH2生成。
① 写出CaH2与水反应的化学方程式 ___________________
写出CaH2与水反应的化学方程式 ___________________
②该同学的判断不正确,原因是_________________
(4)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象___________。
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是____________。
①H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ·mol-1;
查看答案和解析>>
科目:高中化学 来源: 题型:
铜在自然界存在于多种矿石中,如:
| 矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 | CuFeS2 | Cu5FeS4 | Cu2S | CuCO3·Cu(OH)2 |
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是______________。
(2)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是________________。
6Cu+SO2↑,反应的氧化剂是________________。
(3)SO2尾气直接排放到大气中造成环境污染的后果是_______________;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称_________________。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的原理:___________________________________。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是________(填字母)。
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铜绿的主要成分是碱式碳酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ对;有 |
| B | 铜表面易形成致密的氧化膜 | 铜容器可以盛放浓硫酸 | Ⅰ对;Ⅱ对;有 |
| C | 铁比铜活泼 | 铆在铜板上的铁钉在潮湿空气中不易生锈 | Ⅰ对;Ⅱ对;有 |
| D. | 蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 | 硫酸铜溶液可用作游泳池的消毒剂 | Ⅰ错;Ⅱ对;无 |
查看答案和解析>>
科目:高中化学 来源: 题型:
.铁及铁的化合物应用广泛.如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式_______________________________。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应___________________ 负极反应________________________
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤__________________________。
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时约pH | |
| Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢。但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式__________________________
劣质不锈钢腐蚀的实验现象_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是
A.2 mol·L-1 H2SO4溶液
B.18 mol·L-1 H2SO4溶液
C.6 mol·L-1 KOH溶液
D.3 mol·L-1 HNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
21世纪是全世界大规模开发利用海洋资源、发展海洋经济的新时期。为了人类和平利用海洋资源,今年我国环球科学考察船“大洋一号”首次执行环球大洋科学考察任务。
海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表第 族。
(2)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是 (填:物理变化或化学变化)。
(3)工业上利用电解饱和食盐水可制得重要化工产品。反应式为:
食盐+H2O→NaOH+H2↑+Cl2↑(未配平),该反应中食盐的化学式是 ;利用电解所得气体制36.5%的浓盐酸1000t,最少需消耗食盐 t。(可能需要的相对原子质量:Na 23 Cl 35.5
H 1 O 16)
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下:
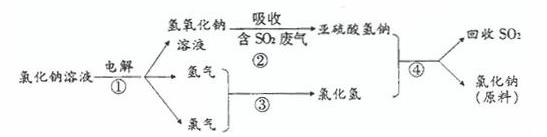
请写出②④的化学反应方程式: 、 。
(5)上述亚硫酸氢钠与甲醛经过一定反应可以合成俗称“吊白块(雕白粉)”的物质,因该物质对人体有害,不能用于食品漂白。“吊白块”结构简式为:HOCH2SO3Na,根据其结构特点,“吊白块”能发生的反应有 。(填字母)
A.皂化反应 B.聚合反应 C.与金属钠反应 D.氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com