

A��CO��HbO2��Ӧ��ƽ�ⳣ��K�� |
| B�����������COԽ�࣬��Ѫ�쵰��ϵ�O2Խ�� |
| C���������CO��O2Ũ��֮�ȴ��ڻ����0.02ʱ���˵������Ż����� |
| D����CO�ж��IJ��˷����ѹ�����нⶾ����ԭ����ʹ����ƽ�������ƶ� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2HI (g)�ﵽƽ��ı�־��
2HI (g)�ﵽƽ��ı�־��| A��H2��I2��HI�ķ�����֮��Ϊ1��1��2 |
| B������������ɫ���ٷ����仯 |
| C����λʱ������n mol H2��ͬʱ���ij�2n mol HI |
| D�����������ܶȱ��ֲ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO(NH2)2+H2O������̼��
CO(NH2)2+H2O������̼��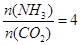 ��CO2��ת������ʱ��ı仯��ϵ����ͼ��ʾ������˵��������ǣ� ��
��CO2��ת������ʱ��ı仯��ϵ����ͼ��ʾ������˵��������ǣ� ��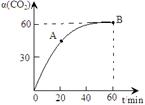
| A���÷�Ӧ��60minʱ�ﵽƽ��״̬ |
| B��NH3��ƽ��ת����Ϊ30% |
| C�����Ӱ�̼�ȿɽ�һ�����CO2��ƽ��ת���� |
| D��A����淴Ӧ���ʦ���(CO2)����B�������Ӧ���ʦ���(CO2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
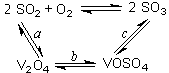
 SO3+ V2O4
SO3+ V2O4 2V2O5+4SO3��
2V2O5+4SO3�� 2SO2+O2��550 ��ʱ��ƽ�ⳣ��K= ��
2SO2+O2��550 ��ʱ��ƽ�ⳣ��K= ��
 2SO3������ֻ�ܱ�����A��B��A������һ�������ƶ��Ļ�����ʹ�����ڱ��ֺ�ѹ��B�����ܱ��ֺ��ݡ���ʼʱ�������������зֱ��������ʵ����������Ϊ2��1��SO2��O2�Ļ�����壬��ʹA��B�ݻ���ȣ�����ͼ��ʾ����
2SO3������ֻ�ܱ�����A��B��A������һ�������ƶ��Ļ�����ʹ�����ڱ��ֺ�ѹ��B�����ܱ��ֺ��ݡ���ʼʱ�������������зֱ��������ʵ����������Ϊ2��1��SO2��O2�Ļ�����壬��ʹA��B�ݻ���ȣ�����ͼ��ʾ����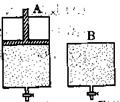
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
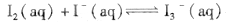 ��ijI2����KI�����Һ�У� c(
��ijI2����KI�����Һ�У� c(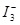 )���¶�T��ƽ������ͼ���¡�����˵������ȷ����
)���¶�T��ƽ������ͼ���¡�����˵������ȷ����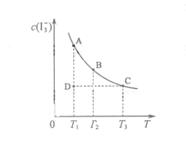
A����Ӧ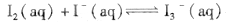 �ġ�H>0 �ġ�H>0 |
B�����¶�Ϊ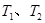 ����Ӧ��ƽ�ⳣ���ֱ�Ϊ ����Ӧ��ƽ�ⳣ���ֱ�Ϊ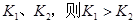 |
C������Ӧ���е�״̬Dʱ��һ����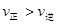 |
| D��״̬A��״̬B��ȣ�״̬A��c(I2) С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2Fe(s)��3CO2(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
2Fe(s)��3CO2(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���| t�� | 1000 | 1150 | 1300 |
| K | 64.0 | 50.7 | 42.9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3(g)��CO2(g)���ڲ�ͬ�¶��£��÷�Ӧ��ƽ��״̬ʱ�IJ������������ʾ������˵����ȷ����(����)
2NH3(g)��CO2(g)���ڲ�ͬ�¶��£��÷�Ӧ��ƽ��״̬ʱ�IJ������������ʾ������˵����ȷ����(����)| �¶� | ƽ��Ũ��(mol·L��1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | | 0.1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)+xD(s)�Ļ�ѧƽ��״̬������������£�M��3 mol A ��2 mol B��2 min��ƽ�⣬����D 1.2 mol����ôӷ�Ӧ��ʼ��ƽ��C������Ϊ0.3 mol��(L��min)-1��N��2 mol C ��y mol D����ƽ��ʱc(A)="0.6" mol��L��1�������ƶϵĽ����в���ȷ����
2C(g)+xD(s)�Ļ�ѧƽ��״̬������������£�M��3 mol A ��2 mol B��2 min��ƽ�⣬����D 1.2 mol����ôӷ�Ӧ��ʼ��ƽ��C������Ϊ0.3 mol��(L��min)-1��N��2 mol C ��y mol D����ƽ��ʱc(A)="0.6" mol��L��1�������ƶϵĽ����в���ȷ���� �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Z(g)����H <0 ��ͼ��ʾ�÷�Ӧ�����ʣ�v����ʱ�䣨t���仯�Ĺ�ϵͼ��t2��t3��t5ʱ��������������ı䣬����û�иı�����ʵ�������������˵���в���ȷ����
Z(g)����H <0 ��ͼ��ʾ�÷�Ӧ�����ʣ�v����ʱ�䣨t���仯�Ĺ�ϵͼ��t2��t3��t5ʱ��������������ı䣬����û�иı�����ʵ�������������˵���в���ȷ����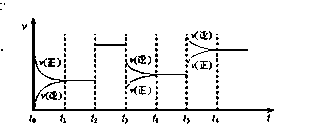
| A��t3ʱ��С��ѹǿ |
| B��t5ʱ������ѹǿ |
| C��t6ʱ�̺�Ӧ���ת������� |
| D��t1 - t2ʱ�÷�Ӧ��ƽ�ⳣ������t6 ʱ��Ӧ��ƽ�ⳣ�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com