
【题目】某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高综合效益,而且还能防止环境污染,生产流程如下:

已知石油裂解已成为生产H的主要方法,E的溶液能发生银镜反应,G是具有香味的液体,试回答下列问题。
(1)F中所含官能团的名称是_____________________________________。
(2)G的结构简式为___________________________。
(3)写出D→E的化学方程式,并注明反应类型:____________________________。
(4)F→G的反应装置如图所示:

a.图中倒置球形干燥管的作用_____________________________;
b.试管Ⅱ中加有饱和Na2CO3溶液,其作用是: ____________________;
c.具有一个羟基的化合物M 10 g,与F反应生成产物11.85 g,并回收了未反应的M 1.3 g,则M的相对分子质量为____;
(5)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ,再测有机物层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中试剂 | 试管II中试剂 | 有机层的厚度/cm |
A | 2ml乙醇、1ml乙酸、1ml18mol/L浓硫酸 | 饱和碳酸钠溶液 | 3.0 |
B | 2ml乙醇、1ml乙酸、 | 0.1 | |
C | 2ml乙醇、1ml乙酸、3ml 2mol/L硫酸 | 0.6 | |
D | 2ml乙醇、1ml乙酸、3ml 1mol/L硫酸 | 0.3 |
a.实验D与实验C相对照可证明___________________________________________________。
b.分析实验A、C的数据,可以推测出浓硫酸的__________提高了乙酸乙酯的产率。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)________。
①单位时间里,生成1 mol乙酸乙酯,同时生成1 mol水
②单位时间里,生成1 mol乙酸乙酯,同时生成1 mol乙酸
③单位时间里,消耗1 mol乙醇,同时消耗1 mol乙酸
④混合物中各物质的浓度不再变化
(7)写出G的一种同分异构体(与G同类)的结构简式:_______________。
【答案】羧基CH3COOC2H5或CH3COOCH2CH32CH3CH2OH + O2![]() 2CH3CHO +2H2O,氧化反应防倒吸溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度116c(H2SO4)越大,酯化反应进行的程度越大吸水性②④CH3CH2COOCH3 或 HCOOCH2CH2CH3或 HCOOCH(CH3)2
2CH3CHO +2H2O,氧化反应防倒吸溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度116c(H2SO4)越大,酯化反应进行的程度越大吸水性②④CH3CH2COOCH3 或 HCOOCH2CH2CH3或 HCOOCH(CH3)2
【解析】
甘蔗渣处理之后得到纤维素,纤维素水解的最终产物为葡萄糖,所以A是纤维素,B是葡萄糖,葡萄糖在酒化酶的作用下反应生成乙醇,则D是乙醇,D发生催化氧化生成E为CH3CHO,E进一步发生氧化反应生成F为CH3COOH,F与D发生酯化反应生成G为CH3COOCH2CH3,葡萄糖在人体内最终氧化得到二氧化碳与水。H与水反应达到乙醇,则H为CH2=CH2。
(1)F为乙酸,故答案为:羧基;(2)G为乙酸乙酯,故答案为:CH3COOC2H5或CH3COOCH2CH3;(3)D→E的反应为醇的催化氧化,故答案为:2CH3CH2OH + O2![]() 2CH3CHO +2H2O,氧化反应;(4)a. 球形干燥管容积较大,起到防止倒吸的作用,故答案为:防倒吸;b. 试管Ⅱ中加有饱和Na2CO3溶液作用是溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度;c.设该化合物为ROH,其相对分子质量为x,实际参加反应的M的质量为:10 g-1.3 g=8.7 g,则反应的化学方程式可表示为:
2CH3CHO +2H2O,氧化反应;(4)a. 球形干燥管容积较大,起到防止倒吸的作用,故答案为:防倒吸;b. 试管Ⅱ中加有饱和Na2CO3溶液作用是溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度;c.设该化合物为ROH,其相对分子质量为x,实际参加反应的M的质量为:10 g-1.3 g=8.7 g,则反应的化学方程式可表示为:
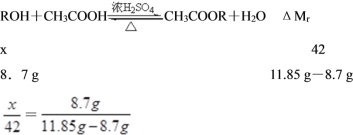
解得:x=116,故答案为:116;
(5)a. 通过实验D与实验C相对照可证明c(H2SO4)越大,酯化反应进行的程度越大;b. 在实验A、C中分别加入了浓硫酸和稀硫酸,对照最终生成酯的厚度可得说明浓硫酸的吸水性提高了乙酸乙酯的产率,故答案为:吸水性;(6)①均指正反应,不能说明正逆反应速率相等;②生成1 mol乙酸乙酯指正反应,同时生成1 mol乙酸指逆反应,且两者相等,故能说明正逆反应速率相等;③消耗1 mol乙醇和消耗1 mol乙酸均指正反应,正逆反应速率可能不等;④混合物中各物质的浓度不再变化说明反应处于平衡状态;故答案为②④;(7)G为酯类化合物,其同类的同分异构体有:CH3CH2COOCH3或HCOOCH2CH2CH3或 HCOOCH(CH3)2。


科目:高中化学 来源: 题型:
【题目】收集NO和NO2两种气体( )
A. 都可用排水法 B. NO用排水法,NO2用向上排气法
C. 都可用向上排气法 D. NO用向上排气法,NO2用排水法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.太阳能以光和热的形式传送到地面,人们可以直接利用这些光和热
B.反应热就是化学反应中放出的能量
C.煤中含有硫元素,大量直接燃烧煤会引起酸雨等环境问题
D.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是

A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-![]() )O2
)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学反应方程式,并判断其反应类型(加成、取代、氧化)
①甲烷与氯气反应_______________________________,属于________反应
②乙烯通入溴水:_________________________________,属于________反应
③乙醇与金属钠反应:__________________________________,属于________反应
④由苯制取硝基苯:_______________________________,属于________反应;
⑤灼热的铜丝多次反复地插入乙醇中:___________________,属于_______反应;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下元素周期表,已知X元素的气态氢化物水溶液呈碱性,空格中均有对应的元素填充。以下说法正确的是( )
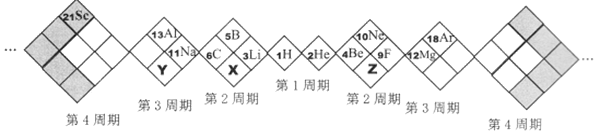
A. X、Y、Z元素分别为N、P、O
B. 白格中都是主族元素,灰格中都是副族元素
C. 因Y元素单质比X元素的单质活泼,故Y元素的非金属性比X要强。
D. X、Y、Z的气态氢化物中最稳定的是:X的氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数的值,下列叙述中正确的是
A. 常温下,9.2gNO2和N2O4的混合气体中含有的氮原子数目为0.2NA
B. 22.4L N2与CO组成的混合气体所含有的电子数为14NA
C. 0.1mol/L K2CO3溶液中所含K+数目为0.2NA
D. 在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每生成3molCl2转移的电子数为6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com