
����Ŀ��һ������CO2��������̼������ɱ�ĺ�ѹ�ܱ������з�ӦC��s��+CO2��g��![]() 2CO��g����ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ��ͼ��ʾ��
2CO��g����ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ��ͼ��ʾ��
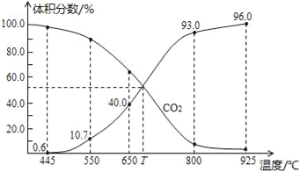
��֪�����ѹ��P�֣�=������ѹ��P�ܣ����������������˵������ȷ����
A.550��ʱ��������������壬v����v������С��ƽ�ⲻ�ƶ�
B.650��ʱ����Ӧ��ƽ���CO2��ת����Ϊ25.0%
C.T��ʱ��������������CO2��CO��ƽ�����ƶ�
D.925��ʱ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��Kp=23.04P��
���𰸡�A
��������
��ѹ�ܱ������з�ӦC��s��+CO2��g��![]() 2CO��g������Ӧ������������������¶����ߣ�������̼����������½�����Ӧ�����ƶ����ʷ�ӦΪ���ȷ�Ӧ��
2CO��g������Ӧ������������������¶����ߣ�������̼����������½�����Ӧ�����ƶ����ʷ�ӦΪ���ȷ�Ӧ��
A. 550��ʱ��������������壬�����������ͬ�ں��ݻ����¼�Сѹǿ��v����v������С��ƽ�������ƶ���A����
B. ��ͼ��֪��650��ʱ����Ӧ��ƽ���һ����̼���������Ϊ40%���迪ʼ����Ķ�����̼Ϊ1mol��ת���� xmol����ƽ��ʱһ����̼��Ϊ2xmol��������̼Ϊ (1-x)mol��![]() ��x=0.25mol����CO2��ת����Ϊ25.0%��B��ȷ��
��x=0.25mol����CO2��ת����Ϊ25.0%��B��ȷ��
C. ��ͼ��֪��T��ʱ���ﵽƽ��״̬ʱ���������������Ϊ50%��������������CO2��CO��ƽ�ⲻ�ƶ���C����
D. 925��ʱ��һ����̼���������Ϊ96%���������̼���������Ϊ4%����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��![]() ����D��ȷ��
����D��ȷ��
��ΪA��


 ��һ������Ԫͬ�����ؾ�ϵ�д�
��һ������Ԫͬ�����ؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯī���缫���KCl��CuSO4(��������)�����Һ,����������ҺpH��ʱ��t�ı仯��ͼ��ʾ,����˵����ȷ����
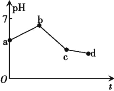
A.ab��H+����ԭ,��Һ��pH����
B.ԭ��Һ��KCl��CuSO4�����ʵ���Ũ��֮��Ϊ2��1
C.c��ʱ��������CuCl2����,���Һ�ɻָ�ԭ��Ũ��
D.cd���൱�ڵ��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦC(s)+H2O(g)![]() CO(g)+H2(g)��һ�ɱ��ݻ����ܱ������н��У����������ĸı���䷴Ӧ���ʼ�����Ӱ����ǣ�������
CO(g)+H2(g)��һ�ɱ��ݻ����ܱ������н��У����������ĸı���䷴Ӧ���ʼ�����Ӱ����ǣ�������
������C���� �ڽ������������Сһ�� �۱���������䣬����N2ʹ��ϵѹǿ���� �ܱ���ѹǿ���䣬����N2ʹ����������
A.�٢�B.�ڢ�C.�٢�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ҫ����;������Ϊ����Դ�����������ƶ�����ǰ���Ľ�������
��1��Li3N����Li��N2��ȼ���Ƶã�ȡ4.164g ���N2��ȼ�գ�����������Li3N__g���ֽ���Liû�з�Ӧ��ʵ�ʷ�Ӧ�����������Ϊ6.840g���������Li3N��������__g��������λС����Li3N��ʽ����34.82��
��2����֪��Li3N+3H2O��3LiOH+NH3����ȡ17.41g����Li3N������100gˮ����ֽ��裬��ȫ��Ӧ����ȴ��20�棬������NH3����ɱ�״���µ������__L�����˳�����ϴ�ӡ����ɣ��õ�LiOH����26.56g������20��ʱLiOH���ܽ��__��������1λС����LiOH��ʽ����23.94��
����ӵ���г��õ�LiCoO2����ҵ�Ͽ���̼������ʽ̼�����Ʊ���
��3������0.5molCoCl2����Һ�뺬0.5molNa2CO3����Һ��ϣ���ַ�Ӧ��õ���ʽ̼���ܳ���53.50g�����ˣ�����Һ�м�������HNO3�ữ��AgNO3��Һ���õ���ɫ����143.50g�����ⶨ��Һ�е�������ֻ��Na+����Na+��1mol����Ӧ�в��������屻����NaOH��Һ��ȫ���գ�ʹNaOH��Һ����13.20g��ͨ������ȷ���ü�ʽ̼���ܵĻ�ѧʽ__��д���Ʊ���ʽ̼���ܷ�Ӧ�Ļ�ѧ����ʽ__��
��4��Co2(OH)2CO3��Li2CO3�ڿ����б����¶�Ϊ600��800�棬���Ƶ�LiCoO2����֪�� 3Co2(OH)2CO3+O2��2Co3O4+3H2O+3CO2��4Co3O4+6Li2CO3+O2��12LiCoO2+6CO2
���ܺ�﮵�ԭ�ӱ�1��1��Ϲ��壬��������70%��800��ʱ��ַ�Ӧ���������������CO2���������__����������λС������֪������ɣ�N2�������0.79��O2�������0.21��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȲΪԭ���ڲ�ͬ�����¿��Ժϳɶ����л��
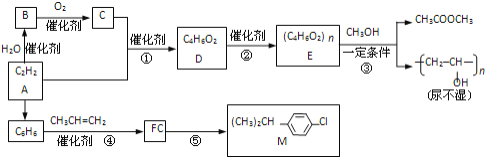
��֪����CH2=CHOH�����ȶ���![]() CH3CHO
CH3CHO
��һ�������£��������ᷢ��������Ӧ��RCOOR��+R��OH![]() RCOOR��+R��OH
RCOOR��+R��OH
���������գ�
��1��д��Ӧ���ͣ���__��Ӧ����__��Ӧ����Ӧ�ݵķ�Ӧ����__��
��2��д����Ӧ����ʽ��B����C__����Ӧ��__��
��3��R��M��ͬϵ��仯ѧʽΪ![]() ����R��__�֣�
����R��__�֣�
��4��д����̼̼˫�����ܷ���������Ӧ����������D��ͬ���칹��Ľṹ��ʽ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�����л������е���Ҫ���ʣ������д��ڵ�˫��������ֵĽṹ��Ϊ����ṹ��������ṹ�Ķ�ϩ����Ϊ����ϩ�������������գ�
(1)���������в����й���ṹ����______�������ţ�
a.![]()
b.![]()
c.![]()
d.CH3CH2CH=CH2
(2)�����ϩ���ļӳ�λ���ж��ֿ��ܣ���Ȼ�ĵ������巴Ӧ�IJ��������_______�֡�
(3)�����ϩ��������������뺬̼̼˫���������Ļ�������мӳɡ����磺

��Ҫ�Ʊ�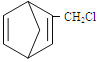 ��������ṹ��ԭ�Ͽ�����___________����д�ṹ��ʽ��
��������ṹ��ԭ�Ͽ�����___________����д�ṹ��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���һԪ��HA����Һ��KOH��Һ�������ϣ���������仯����ʵ���������±���
ʵ���� | ��ʼŨ��/(mol��L-1) | ��Ӧ����Һ��pH | |
c(HA) | c(KOH) | ||
�� | 0.1 | 0.1 | 9 |
�� | x | 0.2 | 7 |
��1��ʵ��ٷ�Ӧ�����ҺpH=9��ԭ����___�������ӷ���ʽ��ʾ����
��2��ʵ��ٺ�ʵ�����ˮ�ĵ���̶Ƚϴ����__������Һ����ˮ�������c(OH-)=__��
��3��x__0.2(������������������=��)����x=a����������HA�ĵ���ƽ�ⳣ��Ka=__���ú�a�ı���ʽ��ʾ����
��4��������֪Ũ�ȵ�KOH�ζ�δ֪Ũ�ȵ�һԪ��HA���ζ��յ���жϷ�����__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������������������Ҫ�����á��ش��������⣺
(1)��֪4NH3(g)+5O2(g)=4NO(g)+6H2O(g)��H1=��alkJ/mol��4NH3(g)+6NO(g)=5N2(g)+6H2O(g)��H2=��bkJ/mol��H2O(1)=H2O(g)��H3=+ckJ/mol��д����298Kʱ������ȼ������N2���Ȼ�ѧ����ʽ___________��
(2)�����еļ��쵰��(Mb)����O2�������MbO2��Mb(aq)+O2(g)![]() MbO2(aq)������k����k���ֱ��ʾ����Ӧ���淴Ӧ�����ʳ�������V��=k����c(Mb)��P(O2)��V��=k����c(MbO2)��37��ʱ��ü��쵰�Ľ�϶�(��)��P(O2)�Ĺ�ϵ���±�[��϶�(��)ָ����O2��ϵļ��쵰��ռ�ܼ��쵰�İٷֱ�]��
MbO2(aq)������k����k���ֱ��ʾ����Ӧ���淴Ӧ�����ʳ�������V��=k����c(Mb)��P(O2)��V��=k����c(MbO2)��37��ʱ��ü��쵰�Ľ�϶�(��)��P(O2)�Ĺ�ϵ���±�[��϶�(��)ָ����O2��ϵļ��쵰��ռ�ܼ��쵰�İٷֱ�]��
P(O2) | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
����MbO2%�� | 50.0 | 67.0 | 80.0 | 85.0 | 88.0 | 90.3 | 91.0 |
�ټ���37�桢P(O2)Ϊ2.00kPaʱ��������Ӧ��ƽ�ⳣ��K=___________��
�ڵ���ƽ��ʱ���쵰����O2�Ľ�϶�(��)��O2��ѹǿ[P(O2)]֮��Ĺ�ϵʽ��=___________(�ú���k����k����ʽ�ӱ�ʾ)��
(3)���ɼ��쵰�ĸʰ���(NH2CH2COOH)��һ���������ʣ�����Һ��������������ʽ���ڣ���ת����ϵ���£�
![]()
![]()
![]()
![]()
![]()
�ڸʰ�����Һ�м�������������ӵİٷֺ������Ĺ�ϵ��ͼ��ʾ��
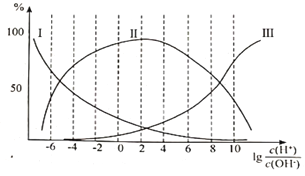
�ٴ��ʰ�����Һ��___________�ԣ�����Һ������ʱ�������ӵ�Ũ���ɴ�С��˳��Ϊ___________��
����![]() =8����Һ�м������HClʱ����Ӧ�����ӷ���ʽΪ___________��
=8����Һ�м������HClʱ����Ӧ�����ӷ���ʽΪ___________��
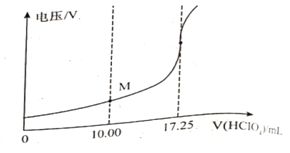
���õ�λ�ζ����ɲⶨij�ʰ�����Ʒ�Ĵ���.
��ȡ��Ʒ150mg����һ�������£���0.1000mol/L�ĸ�������Һ�ζ�(��ʰ���1�U1������Ӧ)����õ�ѹ�仯�����HClO4��Һ�������ϵ����ͼ�����հ���ʵ�飬����HClO4��Һ�����Ϊ0.25mL������Ʒ�Ĵ���Ϊ___________%(����������һλС��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������
A. 0.1mol/L��Na2CO3��Һ������ˮϡ�ͺ���Һ��![]() ���
���
B. ��ʹNa2S��Һ��![]() �ӽ���2�U1���ɼ���������KOH����
�ӽ���2�U1���ɼ���������KOH����
C. 25��ʱ��Ũ�Ⱦ�Ϊ0. 1mol/L NaOH��NH3��H2O�����Һ��c(OH�� )>c(Na+ )=c(NH3��H2O)
D. 0.2 mol/L CH3COOH��Һ��0. 1mol/L NaOH��Һ�������ϣ�2c(H+)��2c(OH ��)=c(CH3COO��)��c(CH3COOH)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com