
【题目】已知Fe2O3 (s)+3CO(g) ![]() 2Fe(s) +3CO2 (g),则反应达平衡后甲、乙两容器中说法不正确的是( )
2Fe(s) +3CO2 (g),则反应达平衡后甲、乙两容器中说法不正确的是( )
起 始 量 | 温度T℃ 平衡常数K=64 恒容且V=1L | ||||
Fe2O3 | CO | Fe | CO2 | ||
甲 | 1 mol | 1 mol | 1 mol | 1 mol | |
乙 | 1 mol | 2 mol | 1 mol | 1mol | |
A.容器中混合气体的平均相对分子质量不变时反应达平衡
B.乙中CO2的体积分数为50%
C.甲中CO的转化率为60%
D.甲、乙两容器中 CO的体积分数相等
【答案】B
【解析】
反应体系中Fe2O3 (s) 、Fe(s) 为固体,则K= =64,则c(CO2 ):c(CO)=4。
=64,则c(CO2 ):c(CO)=4。
A. 反应达到平衡时,气体的质量则不再增加,而气体的物质的量不变,M=![]() ,则摩尔质量不变,容器中混合气体的平均相对分子质量不变时反应达平衡,与题意不符,A不选;
,则摩尔质量不变,容器中混合气体的平均相对分子质量不变时反应达平衡,与题意不符,A不选;
B. 分析可知,达到平衡状态时,c(CO2 ):c(CO)=4,则乙中CO2的体积分数为80%,符合题意,B选;
C. 甲中n(CO)+ n(CO2)=2,则c(CO2 )=1.6mol/L,体积为1L,则n(CO2 )=1.6mol ,反应的n(CO2)=0.6mol,CO的转化率为60%,与题意不符,C不选;
D. 甲、乙两容器中平衡时,c(CO2 ):c(CO)=4,CO的体积分数均为20%,与题意不符,D不选;
答案为B。


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.常温下,加水稀释氨水,稀释过程中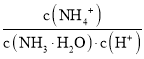 的值不变
的值不变
B.反应NH3(g)+HCl(g)=NH4Cl(s) △H<0在任何条件下均能自发进行
C.常温下电解CuSO4溶液,产生22.4LO2,反应中转移的电子数为4×6.02×1023个
D.为防止浸泡在海水中的闸门腐蚀,可以在闸门上焊接铜块
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Z是制备药物的中间体,合成Z的路线如图所示:
下列有关叙述正确的是( )
A.Y分子中所有原子可能处于同一平面
B.X、Y、Z均能和Na2CO3溶液反应
C.Y、Z都可能使浓溴水褪色,反应原理不相同
D.1molZ跟足量H2反应,最多消耗6molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出以下反应的化学方程式:
(1)Na与水反应:_______
(2)将CO2通入Na2CO3溶液中:_______
(3)将铜粉溶解在浓FeCl3溶液中:_______
(4)向FeCl3溶液中滴加氨水:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
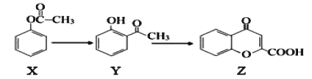
【题目】通过对煤的综合利用,可以获得多种有机物。化合物A含有碳、氢、氧3种元素,其质量比是12:3:8。液态烃B是一种重要的化工原料,其摩尔质量为78 gmol-1。E是有芳香气味的酯。它们之间的转化关系如下(含有相同官能团的有机物通常具有相似的化学性质):
请回答:
(1)化合物A所含的官能团名称是_____________。
(2)B和CH2=CH2反应生成C的反应类型是_____________。
(3)E在氢氧化钠溶液中水解的化学方程式是_____________。
(4)下列说法正确的是_____________。
A.将铜丝在空气中灼烧后迅速插入A中,反应多次,可得到能发生银镜反应的物质
B.在一定条件下,C可通过取代反应转化为![]()
C.苯甲酸钠(常用作防腐剂)可通过D和氢氧化钠反应得到
D.共a mol的B 和D混合物在氧气中完全燃烧,消耗氧气大于7.5a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
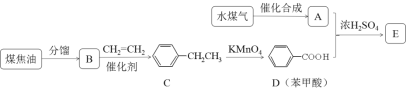
【题目】碳酸亚铁可用于治疗缺铁性贫血。实验室里先制得硫酸亚铁,后将硫酸亚铁与碳酸氢钠反应制得碳酸亚铁(FeSO4+2NaHCO3![]() Na2SO4+FeCO3↓+CO2↑+H2O)。实验装置如下图所示(部分夹持仪器略去)。
Na2SO4+FeCO3↓+CO2↑+H2O)。实验装置如下图所示(部分夹持仪器略去)。
回答下列问题:
(1)A装置中发生反应的化学方程式是________。
(2)实验过程中,将生成的FeSO4溶液和NaHCO3溶液混合的操作是________。
(3)装置B发生反应生成FeCO3的离子方程式是______。
(4)碳酸亚铁在潮湿的空气中逐渐被氧化生成氢氧化铁和一种气体,反应的化学方程式为_________。
(5)配制溶液所用的蒸馏水必须先除去溶解的氧气,具体方法是_______。
(6)设计实验检验制得的产品中是否含Fe3+:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙各取300 mL同浓度的盐酸,加入不同质量的同一镁铝合金粉末进行下列实验,有关数据列表如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 510 | 765 | 918 |
(标准状况)气体体积/mL | 560 | 672 | 672 |
求:(1)盐酸的物质的量浓度是多少________?
(2)合金中镁铝的质量分数各是多少________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 已知冰的熔化热为6.0kJ·mol-1,冰中氢键键能为20kJmol-1,假设每摩尔冰中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键
B. 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,Ka=(ca)2/c(1-a)。若加水稀释,,则CH3COOH![]() CH3COO-+H+向右移动,a增大,Ka不变
CH3COO-+H+向右移动,a增大,Ka不变
C. 甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
D. 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对铜、铁与硝酸的反应进行实验探究。回答下列问题:
(1)验证铜与硝酸的反应(实验装置如图所示)。已知仪器a中盛有足量的一定浓度的硝酸溶液,试管b中盛有6.4g铜片。
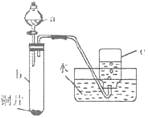
①仪器a的名称是___。
②在铜与硝酸的反应中,硝酸所表现出的化学性质主要有___。
③待试管b中铜片完全消失。如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是___ g。
(2)探究铁与稀硝酸的反应。用5.6gFe粉和含有0.3molHNO3的稀硝酸进行实验,若两种物质恰好完全反应,且HNO3只被还原成NO。
①Fe粉与稀硝酸反应生成硝酸铁的化学方程式为___。
②Fe粉与稀硝酸反应生成硝酸亚铁的离子方程式为___。
③反应结束后的溶液中Fe3+、Fe2+的物质的量之比n(Fe3+):n(Fe2+)=___。
④标准状况下,生成NO气体的体积为___L(保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com