
【题目】写出以下反应的化学方程式:
(1)Na与水反应:_______
(2)将CO2通入Na2CO3溶液中:_______
(3)将铜粉溶解在浓FeCl3溶液中:_______
(4)向FeCl3溶液中滴加氨水:_______
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
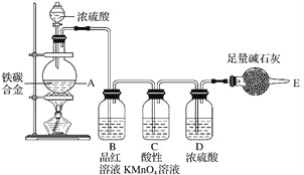
(1)mg铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
①常温下碳与浓硫酸不反应;
②__。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式__。
(3)B中的现象是__,C的作用是__。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为__(写表达式)。
(5)甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因:__。
(6)本套装置在设计上存在缺陷,其中导致测得铁的质量分数偏低的是(答一条即可)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇与水蒸气重整制氢可直接用于燃料电池。回答下列问题:
(1)已知甲醇分解反应:CH3OH(g) ![]() CO(g)+2H2(g) △H1=+90.64 kJ/mol
CO(g)+2H2(g) △H1=+90.64 kJ/mol
水蒸气变换反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H2=-41.20 kJ/mol
CO2(g)+H2(g) △H2=-41.20 kJ/mol
则CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) △H3=____________kJ/mol
CO2(g)+3H2(g) △H3=____________kJ/mol
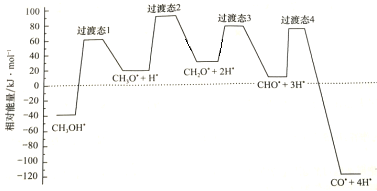
(2)科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。此历程中活化能最小的反应方程式为________________________________________________。
(3)在0.1MPa下,将总进料量1mol且n(CH3OH):n(H2O)=1:1.3的混合气体充入一刚性密闭容器中反应。
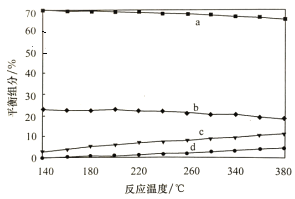
①实验测得水煤气变换反应的速率随温度的升高明显下降,原因是_____________。
②平衡时,测得CH3OH的含量在给定温度范围内极小,H2、H2O(g)、CO、CO2四种组分含量与反应温度关系如图所示,a、c曲线对应物质的化学式分别为_______________、______________。
(4)573.2K时,向一刚性密闭容器中充入5.00 MPa CH3OH使其分解,t h后达平衡时H2的物质的量分数为60%,则t h内v(CH3OH)=_____________MPa/h,其平衡常数分压Kp=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】满足下列条件的有机物的种类数正确的是
选项 | 有机物 | 条件 | 种类数 |
A | C5H10O2 | 在酸性条件下会水解生成甲和乙,且甲、乙的相对分子质量相等 | 4 |
B | C6H12O2 | 能与 NaHCO3溶液反应 | 3 |
C | C5H12O | 含有2个甲基的醇 | 5 |
D |
| 该有机物的一氯代物 | 4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种短周期主族元素的原子序数的大小顺序为C>A>B>D>E;其中,A、C同周期,B、C同主族;A与B 形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子。试回答下列问题:
(1)画出元素C的原子结构示意图:____________________。
(2)写出元素D在元素周期表中的位置:_______________ ;该元素形成的单质的结构式为______。
(3)写出下列物质的电子式:A、B、E形成的化合物 __________________。
(4)A、B两元素组成的化合物A2B2存在的化学键有 ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两气体A、B分别为0.6mo1与0.5mo1,在0.4L密闭容器中发生反应:3A+BmC+2D(C、D均为气态物质),经5min后达到平衡,此时C为0.2mo1,在此时间内D的平均反应速率为0.1mo1L-1min-1,下列结论错误的是( )
A.平衡时反应混合物总物质的量为1mo1
B.B的转化率为20%
C.A的平均反应速率为0.15mo1L-1min-1
D.m值为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe2O3 (s)+3CO(g) ![]() 2Fe(s) +3CO2 (g),则反应达平衡后甲、乙两容器中说法不正确的是( )
2Fe(s) +3CO2 (g),则反应达平衡后甲、乙两容器中说法不正确的是( )
起 始 量 | 温度T℃ 平衡常数K=64 恒容且V=1L | ||||
Fe2O3 | CO | Fe | CO2 | ||
甲 | 1 mol | 1 mol | 1 mol | 1 mol | |
乙 | 1 mol | 2 mol | 1 mol | 1mol | |
A.容器中混合气体的平均相对分子质量不变时反应达平衡
B.乙中CO2的体积分数为50%
C.甲中CO的转化率为60%
D.甲、乙两容器中 CO的体积分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H溴丙胺太林(普鲁本辛)属于抗胆碱类药物,用于胃和十二指肠溃疡的辅助治疗,亦用于胃炎、胰腺炎。某合成路线如下:
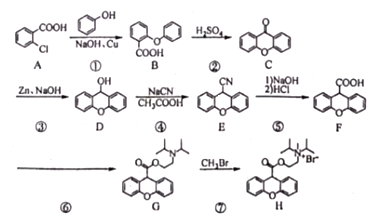
回答下列问题:
(1)A的化学名称为__________,E的分子式为__________________。
(2)①的反应类型为_____________。
(3)反应⑥的化学方程式为________________________________________________。
(4)H中含氧官能团的名称是_____________。
(5)N是D的同分异构体,含有联苯(![]() )结构,可与银氨溶液发生银镜反应,与
)结构,可与银氨溶液发生银镜反应,与![]() 溶液发生显色反应。符合该条件的D共有___________种;其中核磁共振氢谱为六组,峰面积比为1:2:2:2:2:1的结构简式为____________________________。
溶液发生显色反应。符合该条件的D共有___________种;其中核磁共振氢谱为六组,峰面积比为1:2:2:2:2:1的结构简式为____________________________。
(6)苯乙酸乙酯为合成香料,用于配制各种花香型日用香精。其一种合成路线为:

条件a为__________________,最后一步反应,乙醇稍过量的目的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知拆开1 mol氢气中的化学键需要消耗436 kJ能量,拆开1 mol氧气中的化学键需要消耗498 kJ能量,根据能量变化示意图,下列说法不正确的是
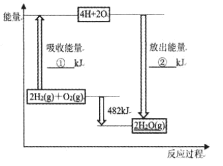
A.①、②的数值分别为1370、1852
B.拆开H2O(g)中的1 molH-O键吸收463kJ的能量
C.2H2(g)+O2(g)=2H2O(g) △H=-482kJ·mol-1
D.已知H2O(1)=H2O(g) △H>0,说明lmolH2O(1)的能量比1molH2O(g)高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com