
【题目】满足下列条件的有机物的种类数正确的是
选项 | 有机物 | 条件 | 种类数 |
A | C5H10O2 | 在酸性条件下会水解生成甲和乙,且甲、乙的相对分子质量相等 | 4 |
B | C6H12O2 | 能与 NaHCO3溶液反应 | 3 |
C | C5H12O | 含有2个甲基的醇 | 5 |
D |
| 该有机物的一氯代物 | 4 |
A.AB.BC.CD.D
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素,![]() 为地壳中含量最高的过渡金属元素,
为地壳中含量最高的过渡金属元素,![]() 与
与![]() 同主族,
同主族,![]() 与
与![]() 同周期,且
同周期,且![]() 与
与![]() 的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
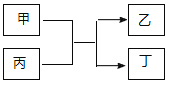
A.![]() 、
、![]() 形成的一种化合物具有漂白性
形成的一种化合物具有漂白性
B.![]() 、
、![]() 形成的离子化合物可能含有非极性键
形成的离子化合物可能含有非极性键
C.![]() 的单质能与丙反应置换出
的单质能与丙反应置换出![]() 的单质
的单质
D.丁为黑色固体,且1mol甲与足量丙反应转移电子3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A、E在元素周期表中的相对位置如图,A与氧元素能形成两种无色气体,C是地壳中含量最多的元素,D是地壳中含量最多的金属元素。
A | ||
E |
(1)C在元素周期表中的位置为____。
(2)AE2的电子式为___。
(3)C、E、F的单质沸点最低的是__(填化学式)。
(4)C、D、E、F的离子半径由大到小的顺序是___(填离子符号)。
(5)实验室制取F2气体的离子方程式为___。
(6)在微电子工业中,B的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是( )
A.50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA
B.2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0.2NA之间
C.用惰性电极电解饱和食盐水,若线路中通过NA 个电子,则阴极产生11.2L (标况)气体
D.已知N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92kJ·mol-1,现有0.1molN2与0.3molH2混合反应,可放热9.2kJ
2NH3(g) ΔH=-92kJ·mol-1,现有0.1molN2与0.3molH2混合反应,可放热9.2kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Z是制备药物的中间体,合成Z的路线如图所示:
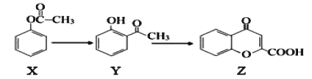
下列有关叙述正确的是( )
A.Y分子中所有原子可能处于同一平面
B.X、Y、Z均能和Na2CO3溶液反应
C.Y、Z都可能使浓溴水褪色,反应原理不相同
D.1molZ跟足量H2反应,最多消耗6molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸溶液是常用的消毒剂和漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即反应生成 HClO。
资料2:将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,用水吸收Cl2O(不含Cl2)制得次氯酸溶液。(装置及实验)用以下装置制备次氯酸溶液。
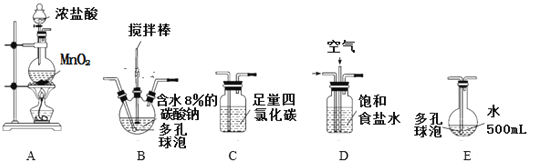
回答下列问题:
(1)各装置的连接顺序为_____→_____→_____→____→E。
(2)反应过程中,装置B需放在冷水中,其目的是_________________________。
(3)装置C的主要作用是______________________。
(4)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为_________g。
(5)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定E中次氯酸溶液的物质的量浓度的实验方案为:用________________准确量取20.00 mL次氯酸溶液,加入足量的________溶液,再加入足量的________溶液,过滤,洗涤,真空干燥,称量沉淀的质量。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出以下反应的化学方程式:
(1)Na与水反应:_______
(2)将CO2通入Na2CO3溶液中:_______
(3)将铜粉溶解在浓FeCl3溶液中:_______
(4)向FeCl3溶液中滴加氨水:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁可用于治疗缺铁性贫血。实验室里先制得硫酸亚铁,后将硫酸亚铁与碳酸氢钠反应制得碳酸亚铁(FeSO4+2NaHCO3![]() Na2SO4+FeCO3↓+CO2↑+H2O)。实验装置如下图所示(部分夹持仪器略去)。
Na2SO4+FeCO3↓+CO2↑+H2O)。实验装置如下图所示(部分夹持仪器略去)。
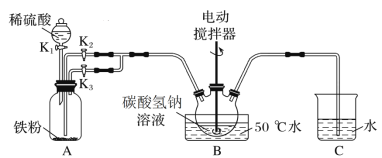
回答下列问题:
(1)A装置中发生反应的化学方程式是________。
(2)实验过程中,将生成的FeSO4溶液和NaHCO3溶液混合的操作是________。
(3)装置B发生反应生成FeCO3的离子方程式是______。
(4)碳酸亚铁在潮湿的空气中逐渐被氧化生成氢氧化铁和一种气体,反应的化学方程式为_________。
(5)配制溶液所用的蒸馏水必须先除去溶解的氧气,具体方法是_______。
(6)设计实验检验制得的产品中是否含Fe3+:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为:MnO2+![]() Zn+(1+
Zn+(1+![]() ) H2O+
) H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4[Zn(OH)2]3·xH2O,其电池结构如图1所示,图2是有机高聚物的结构片段。
ZnSO4[Zn(OH)2]3·xH2O,其电池结构如图1所示,图2是有机高聚物的结构片段。
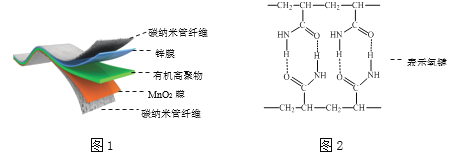
下列说法中,不正确的是( )
A.碳纳米管具有导电性,可用作电极材料
B.合成有机高聚物的单体是:![]()
C.充电时,Zn2+移向Zn膜
D.放电时,电池的正极反应为:MnO2 + e + H+ = MnOOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com