
【题目】将30 mL 0.5mol/L的NaOH溶液加水稀释到500 mL,稀释后NaOH的物质的量浓度为( )
A.0.3 mol/LB.0.03 mol/LC.0.05 mol/LD.0.04 mol/L
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】金刚砂(SiC)可由 SiO2 和碳在一定条件下反应制得,在反应方程式为 SiO2+3C![]() SiC+2CO↑中,下列有关制造金刚砂的说法中正确的是
SiC+2CO↑中,下列有关制造金刚砂的说法中正确的是
A. 该反应中的氧化剂是 SiO2,还原剂为 C
B. 该反应说明了C 的还原性小于SiC
C. 该反应中转移的电子数为 12e-
D. 该反应中的还原产物是 SiC、氧化产物是 CO,其物质的量之比为 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质X逐渐加入(或通入)Y溶液中,其生成沉淀的量与加入X的物质的量的关系如下图所示,符合图示情况的是( )
| A | B | C | D |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41kJ/mol,相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) △H=-41kJ/mol,相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量: 32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q |
下列说法中,不正确的是
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中的平衡常数等于容器②中平衡常数
C. Q=32.8
D. 容器①中CO反应速率等于H2O的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 滴入酚酞呈无色的溶液中:K+、Al3+、Cl-、CO32-
B. 澄清的溶液中:Na+、K+、MnO4—、AlO2—
C. ![]() =10-13mol·L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3-
=10-13mol·L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3-
D. c(I-)=0.1 mol·L-1的溶液中:Na+、H+、ClO-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用下列装置进行电化学实验,下列实验操作及预期现象正确的是( )
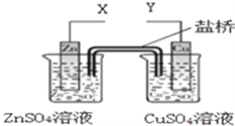
A. X和Y与电流表连接,Cu极为正极,发生氧化反应
B. X和Y与电流表连接,盐桥中的阴离子移向CuSO4溶液
C. X和Y分别与电源“﹣”、“+”极相连,Cu极质量减轻
D. X和Y分别与电源“+”、“﹣”极相连,Zn极电极反应为4OH﹣﹣4e﹣═O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,其中X、Z同主族,Y原子的最外层电子数为次外层电子数的一半,X原子的最外层电子数是其核外电子层数的3倍。下列说法不正确的是
A. 最简单气态氢化物的热稳定性,W>Z>Y B. 单质的沸点:Y>X>Z
C. 简单离子半径:Z>W>X D. X的氢化物中可能含有非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
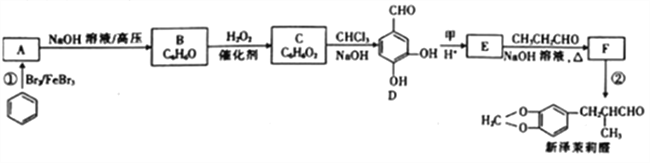
【题目】新泽茉莉醛是一种名贵的香料.其合成路线如下:
已知:①RCHO+R'CH2CHO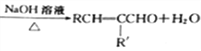
②
(1)已知甲的相对分子质量为30,甲的结构简式为____。E中含氧官能团的名称是____。
(2)反应②的反应类型是____ 。
(3)写出反应①的化学方程式:_________________。
(4)芳香族化合物G与E互为同分异构体,1molG能与足量NaHCO3溶液反应产生1mol气体,且G能发生银镜反应。则G的结构有______种。其中一种结构苯环上的一氯代物有两种,且被氧化后能与C反应生成高分子化合物,写出该高分子化合物的结构简式:_______。
(5)结合已知①,设计以乙醇和苯甲醛![]() 为原料(无机试剂任选)制备
为原料(无机试剂任选)制备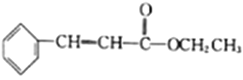 的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com