
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41kJ/mol,相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) △H=-41kJ/mol,相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量: 32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q |
下列说法中,不正确的是
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中的平衡常数等于容器②中平衡常数
C. Q=32.8
D. 容器①中CO反应速率等于H2O的反应速率
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,将一定量的A、B气体充入密闭容器,发生反应:A(g)+B(g)![]() xC(?)+3D(?)。反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如下图所示。下列有关说法正确的是
xC(?)+3D(?)。反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如下图所示。下列有关说法正确的是
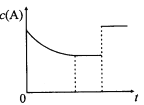
A.x=2,C为气态,D可能为气态也可能为非气态
B.改变的条件可能是使用了催化剂
C.其他条件不变,若向容器中加入少量C,A的平衡转化率不变
D.该反应的化学平衡常数K=[c(C)]2/c(A) ·c(B),且温度升高,K值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由二氧化硅制高纯硅的流程如下,下列判断中错误的是

A. ①②③均属于氧化还原反应 B. H2和HCl均可循环利用
C. SiO2是一种坚硬难熔的固体 D. SiHCl3摩尔质量为135.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在配合物Fe(SCN)2+中提供空轨道接受孤电子对的微粒是____(填符号),配合物离子[Cu(NH3)4]2+为平面正方形结构, 画出其中的配位键_____________。
(2)配合物Co[(N3)(NH3)5]SO4中Co3+的配位数为___,Co3+与NH3之间的作用属于_____(选填“离子键”、“配位键”、“范德华力”、“氢键”)。
(3)Co(Ⅲ)的八面体配合物CoClm·nNH3,若1 mol配合物与AgNO3作用生成1 molAgCl沉淀,则m=__________, n= ___________。(填具体数值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池与电解池在生活和生产中有着广泛应用。下列有关判断中错误的是( )
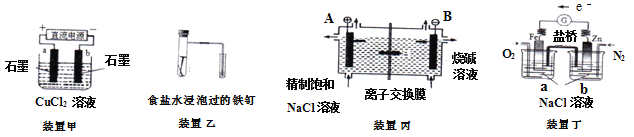
A. 装置甲研究的是电解CuCl2溶液,它将电能转化为化学能
B. 装置乙研究的是金属的吸氧腐蚀,Fe上的反应为Fe - 2e -- = Fe2+
C. 装置丙研究的是电解饱和食盐水,B电极发生的反应:2Cl- -2e-- = Cl2↑
D. 向装置丁烧杯a中加入少量K3[Fe(CN)6]溶液,没有蓝色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如图所示
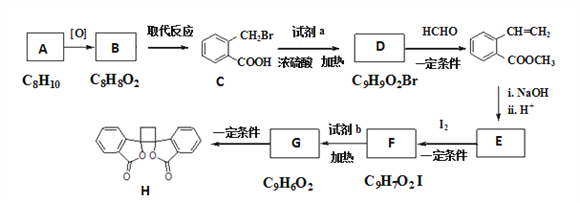
已知: ①RCH2Br ![]() R﹣HC═CH﹣R′
R﹣HC═CH﹣R′
②R﹣HC═CH﹣R′![]()
![]()
③R﹣HC═CH﹣R′![]()
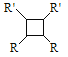 (以上R、R'、R'代表氢、烷基或芳基等)
(以上R、R'、R'代表氢、烷基或芳基等)
(1)A属于芳香烃,其名称是____;C中官能团的名称是____;由G生成H的反应类型为____;
(2)试剂a的结构简式是____,试剂b为____;由C生成D的化学方程式是____。
(3)下列说法正确的是____
A.E中含有3种官能团 B.1mol H与足量NaOH溶液反应,消耗2mol NaOH
C.由F生成G的反应是消去反应 D.1mol G最多可以与3mol H2发生加成反应
(4)与化合物C具有相同官能团且属于芳香族化合物的同分异构体共有____ 种(包括C本身)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将30 mL 0.5mol/L的NaOH溶液加水稀释到500 mL,稀释后NaOH的物质的量浓度为( )
A.0.3 mol/LB.0.03 mol/LC.0.05 mol/LD.0.04 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(己知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是
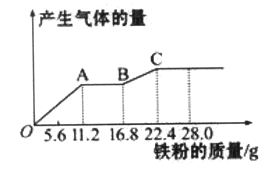
A. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
B. 原混合酸中NO3-物质的量为0.4 mol
C. 第二份溶液中最终溶质为FeSO4
D. 取20 mL原混合酸加水稀释至1 L后溶液c(H+) =0.1mol L-l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程如下:

已知:①Fe3+、Cu2+开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4。
②Ksp[Cu(OH)2]=2×10-20
③AsO2-+H2O2+H+=H3AsO4, H3AsO4+Fe3+=FeAsO4↓+3H+
(1)溶解操作中需要配制含铜32 g·L-1的硫酸铜溶液1.0 L,需要称量冶炼级硫酸铜的质量至少为___________g。
(2)测定溶解液中的Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用
________(“酸式”或“碱式”)滴定管,其中反应离子方程式为:______________________。若要检验调节pH后溶液中的Fe3+已除尽的方法是___________________________。
(3)氧化后需要将溶液进行稀释及调节溶液的pH=5,则稀释后的溶液中铜离子浓度最大不能超过____________mol·L-1。
(4)固体Ⅰ的主要成分除 FeAsO4 、Fe(OH)3外还有__________________,由溶液Ⅰ获得CuSO4·H2O,需要经过________ 、____________、过滤、洗涤、干燥操作。
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含锌、银、铂杂质)制备纯铜,写出阳极发生的电极反应式:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com