
【题目】下列说法正确的是
A.键角:BF3>CH4>H2O>NH3
B.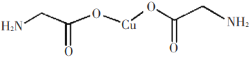 中σ键和π键比例为7:1
中σ键和π键比例为7:1
C.已知二茂铁(Fe(C5H5)2)熔点是173![]() (在100
(在100![]() 时开始升华),沸点是249
时开始升华),沸点是249![]() ,不溶于水,易溶于苯等非极性溶剂。在二茂铁结构中,
,不溶于水,易溶于苯等非极性溶剂。在二茂铁结构中,![]() 与Fe2+之间是以离子键相结合
与Fe2+之间是以离子键相结合
D.在硅酸盐中,![]() 四面体通过共用顶角氧离子形成一种无限长单链结构的多硅酸根如图a,其中Si原子的杂化方式与b图中S8单质中S原子的杂化方式相同
四面体通过共用顶角氧离子形成一种无限长单链结构的多硅酸根如图a,其中Si原子的杂化方式与b图中S8单质中S原子的杂化方式相同
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】体NH4Br置于密闭容器中,在某温度下,发生反应:NH4Br(s)![]() NH3(g)+HBr(g),2HBr(g)
NH3(g)+HBr(g),2HBr(g)![]() Br2(g)+H2(g),2 min后,测知H2的浓度为0.5 mol·L-1,HBr的浓度为4 mol·L-1,若上述反应速率用v(NH3)表示,则下列速率正确的是( )
Br2(g)+H2(g),2 min后,测知H2的浓度为0.5 mol·L-1,HBr的浓度为4 mol·L-1,若上述反应速率用v(NH3)表示,则下列速率正确的是( )
A. 0.5 mol·L-1·min-1B. 2.5 mol·L-1·min-1
C. 2 mol·L-1·min-1D. 1.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:

下列有关胆矾的说法不正确的是
A.胆矾中有轨道杂化的氧原子和硫原子杂化方式为sp3
B.胆矾中含有的作用力有离子键、极性共价键、配位键、氢键
C.Cu2+价电子排布式为3d84s1
D.胆矾的结晶水在不同温度下会分步失去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A. 油脂在人体内水解为氨基酸和甘油等小分子后被人体吸收
B. 甲酸甲酯(HCOOCH3)和乙酸是同分异构体
C. 石油催化裂化的主要目的是提高芳香烃的产量
D. 聚丙烯的结构简式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上处理有机废水的一种方法是:在调节好pH和Mn2+浓度的废水中加入H2O2,使有机物氧化降解。现设计如下对比实验(实验条件见下表),实验测得有机物R浓度随时间变化的关系如下图所示。下列说法正确的是


A.313K时,在0~100s内有机物R降解的平均速率为:0.014 mol·L-1·s-1
B.对比①②实验,可以得出温度越高越有利于有机物R的降解
C.对比①②实验,可以发现在两次实验中有机物R的降解百分率不同
D.通过以上三组实验,若想使反应停止,可以向反应体系中加入一定量的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃是重要的有机化工原料。实验室主要用浓硫酸或浓磷酸作催化剂使醇脱水制取烯烃。某同学使用环己醇脱水制备环己烯。设计方案如下:
(一)主要仪器和试剂
仪器:50mL圆底烧瓶、分馏柱、直形冷凝管、10mL量筒、分液漏斗、100mL锥形瓶、蒸馏头、接液管。
试剂:10.0g(10.4mL,0.1mol)环己醇、5mL浓磷酸、氯化钠、无水氯化钙、5%碳酸钠水溶液。
(二)查阅实验所涉及的反应物、催化剂、产物的各种物理性质,列表如下:
化学物质 | 相对分子 质量 | 相对密度/ g·cm-3 | 沸点/℃ | 溶解性 |
环己醇 | 100 | 0.96 | 161.1 | 稍溶于水 |
磷酸(85%) | 98 | 1.83 | 213 | 易溶于水 |
环己烯 | 82 | 0.89 | 83.3 | 微溶于水 |
(三)实验流程

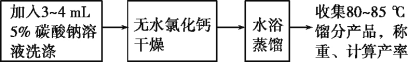
请回答:
(1)加热过程中,若忘记加沸石,应如何操作?___
(2)将粗产品分去水层所需要用到的主要实验仪器是___。
(3)本实验用浓磷酸代替浓硫酸的优点:___。
(4)该实验的主要副产物为___(填物质名称)。
(5)在提纯环己烯时,用等体积的饱和食盐水,而不用水的原因是___。加入3~4mL5%碳酸钠溶液的目的是___。
(6)水浴蒸馏最后得到7.0g产品,则反应的产率为___(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)基态F原子的价层电子的轨道表达式为____。
(2)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为_____,与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是_____和_____(各举一例)。
(3)NH4F(氟化铵)可用于玻璃的蚀刻防腐剂、消毒剂。![]() 中中心原子的杂化类型是_____;氟化铵中存在的化学键是_____(填字母)。
中中心原子的杂化类型是_____;氟化铵中存在的化学键是_____(填字母)。
A.离子键 B.σ键 C.π键 D.氢键
(4)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图计算相关键能。则F-F键的键能为____kJ·mol-1,S-F键的键能为____kJ·mol-1。
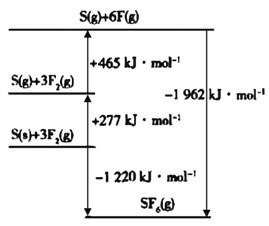
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池和液晶显示器制造中得到广泛应用。![]() 是一种三角锥型分子,键角
是一种三角锥型分子,键角![]() ,沸点
,沸点![]() ;可在铜的催化作用下由
;可在铜的催化作用下由![]() 和过量
和过量![]() 反应得到:
反应得到: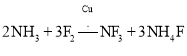
![]() 上述化学方程式中的5种物质所含的化学键类型有 ______
上述化学方程式中的5种物质所含的化学键类型有 ______ ![]() 填序号
填序号![]() 。
。
![]() 离子键
离子键![]() 共价键
共价键![]() 配位键
配位键![]() 金属键
金属键
![]() 与铜属于同一周期,且未成对价电子数最多的元素基态原子价电子排布式为 ______ 。
与铜属于同一周期,且未成对价电子数最多的元素基态原子价电子排布式为 ______ 。
![]() 的沸点比
的沸点比![]() 的沸点
的沸点![]() 低得多的主要原因是 ______ 。
低得多的主要原因是 ______ 。
![]() 理论上HF、
理论上HF、![]() 和NaCl按6:1:2的物质的量之比恰好反应生成HCl、
和NaCl按6:1:2的物质的量之比恰好反应生成HCl、![]() 和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用.该物质为配合物,其中心离子是 ______ ,配位数为 ______ 。
和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用.该物质为配合物,其中心离子是 ______ ,配位数为 ______ 。
![]() 根据下列五种元素的第一至第四电离能数据
根据下列五种元素的第一至第四电离能数据![]() 单位:
单位:![]()
![]() ,回答下面各题:
,回答下面各题:
元素代号 |
|
|
|
|
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一族的是 ______ 和 ______ 。
②T元素最可能是 ______ (填“s”、“p”、“d”、“ds”等)区元素。若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为 ______ ,其中心原子的杂化轨道类型为 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL ![]() 溶液中滴加
溶液中滴加![]() 的
的![]() 溶液,滴加过程中,溶液中
溶液,滴加过程中,溶液中![]() 与
与![]() 溶液体积(V)的关系如图所示,下列说法正确的是( )已知:
溶液体积(V)的关系如图所示,下列说法正确的是( )已知: ![]() 。
。
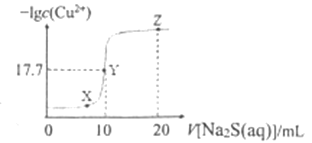
A. 该温度下 ![]()
B. X、Y、Z三点中,Y点水的电离程度最小
C. ![]() 溶液中:
溶液中:![]()
D. 向100 mL ![]() 浓度均为
浓度均为![]() 的混合溶液中逐滴加入
的混合溶液中逐滴加入![]() 的
的![]() 溶液,
溶液,![]() 先沉淀
先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com