
【题目】某温度下,向10 mL ![]() 溶液中滴加
溶液中滴加![]() 的
的![]() 溶液,滴加过程中,溶液中
溶液,滴加过程中,溶液中![]() 与
与![]() 溶液体积(V)的关系如图所示,下列说法正确的是( )已知:
溶液体积(V)的关系如图所示,下列说法正确的是( )已知: ![]() 。
。
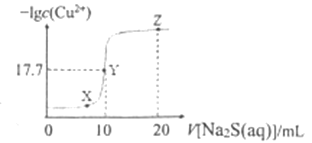
A. 该温度下 ![]()
B. X、Y、Z三点中,Y点水的电离程度最小
C. ![]() 溶液中:
溶液中:![]()
D. 向100 mL ![]() 浓度均为
浓度均为![]() 的混合溶液中逐滴加入
的混合溶液中逐滴加入![]() 的
的![]() 溶液,
溶液,![]() 先沉淀
先沉淀
【答案】B
【解析】
向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,发生反应:Cu2++S2-CuS↓,Cu2+单独存在或S2-单独存在均会水解,水解促进水的电离,Y点溶液时滴加Na2S溶液的体积是10mL,此时恰好生成CuS沉淀,CuS存在沉淀溶解平衡:CuS(s)![]() Cu2+(aq)+S2-(aq),已知此时-lgc(Cu2+)=17.7,则平衡时c(Cu2+)=c(S2-)=10-17.7mol/L,Ksp(CuS)= c(Cu2+)c(S2-)=10-17.7mol/L×10-17.7mol/L=10-35.4mol2/L2,据此结合物料守恒分析。
Cu2+(aq)+S2-(aq),已知此时-lgc(Cu2+)=17.7,则平衡时c(Cu2+)=c(S2-)=10-17.7mol/L,Ksp(CuS)= c(Cu2+)c(S2-)=10-17.7mol/L×10-17.7mol/L=10-35.4mol2/L2,据此结合物料守恒分析。
A. 该温度下,平衡时c(Cu2+)=c(S2-)=10-17.7mol/L,则Ksp(CuS)= c(Cu2+)c(S2-)=10-17.7mol/L×10-17.7mol/L=10-35.4mol2/L2,A错误;
B.Cu2+单独存在或S2-单独存在均会水解,水解促进水的电离,Y点时恰好形成CuS沉淀,水的电离程度小于X、Z点,所以X、Y、Z三点中,Y点水的电离程度最小,B正确;
C.根据Na2S溶液中的物料守恒可知:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+),C错误;
D.向100mLZn2+、Cu2+浓度均为10-5mol/L的混合溶液中逐滴加入10-4mol/L的Na2S溶液,产生ZnS时需要的S2-浓度为c(S2-)=![]() mol/L=3×10-20mol/L,产生CuS时需要的S2-浓度为c(S2-)=
mol/L=3×10-20mol/L,产生CuS时需要的S2-浓度为c(S2-)= ![]() =10-30.4mol/L<3×10-20mol/L,则产生CuS沉淀时所需S2-浓度更小,即Cu2+先沉淀,D错误;
=10-30.4mol/L<3×10-20mol/L,则产生CuS沉淀时所需S2-浓度更小,即Cu2+先沉淀,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)

(1)装置B中发生反应的化学方程式是__________________________。
(2)装置E中的现象是_____________________________________。
(3) 该小组学生利用B装置的固体与足量盐酸反应后的滤液制取FeCl3·6H2O晶体,设计流程如图所示:
![]()
①步骤I中通入Cl2的作用是______________________________。
② 简述检验滤液中Fe3+的操作方法________________________。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)被誉为尖端技术等工业的维生素。工业上常以粗铜精炼的阳极泥(主要成分是![]() ,含
,含![]() 等杂质)为原料提取碲并回收金属,其工艺流程如下图所示:
等杂质)为原料提取碲并回收金属,其工艺流程如下图所示:

已知:Te与S同一主族,比S原子多2个电子层;![]() 是两性氧化物,微溶于水。请回答要求下列问题:
是两性氧化物,微溶于水。请回答要求下列问题:
(1)碲的原子序数为___________;其最高价氧化物对应的水化物化学式为___________。该族2~5周期元素单质分别与反应生成1 mol气态氢化物的反应热如下,其中表示生成1 mol碲化氢反应热的是(填序号字母)___________。
a. +99.7![]() b. -29.7
b. -29.7![]() c. -20.6
c. -20.6![]() d. -241.8
d. -241.8![]()
(2)步骤①中发生了(填“氧化”或“还原”或“非氧化还原”)___________反应;此过程控制pH不宜过低的原因是_________;“加压”的目的是________________。
(3)步骤②当温度过高时,会导致碲的浸出率降低,原因是____________。若从滤渣X中分离出Au ,需加入某试剂,该反应的化学议程式为_________________。
(4)步骤③铜从(填“阳”或“阴”)______极得到。写出步骤④的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图所示。R原子最外层电子数Q原子最外层电子数的4倍,Q的简单离子核外电子排布与Z2-相同。下列相关叙述不正确的是

A. 化合物![]() 中含有离子键
中含有离子键
B. 五种元素中Q的金属性最强
C. 气态氢化物的稳定性:![]()
D. 最高价氧化物对应的水化物酸性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体在2 L的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g) ![]() 2C(g)。若经2 s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1 ;
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1;
③2s时物质A的转化率为30% ;
④2s时物质B的浓度为1.4mol·L-1。
其中正确的是( )
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将标准状况下6.72LHCl溶于水配成100mL溶液,取该溶液40mL与一定量的碳酸钙恰好完全反应。计算:
(1)此盐酸的物质的量浓度。(写出计算过程,下同)_____________________
(2)参与反应的碳酸钙的质量是多少?_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙烯并检验乙烯性质的装置如下图。

请回答有关问题:
(1)烧瓶中除反应物以外,还应放2-3块碎瓷片,目的是_________________;
(2)烧瓶中产生乙烯的反应方程式为:_________________,反应类型为:_________________;C中发生反应的化学方程式为:_________________,反应类型为:_________________;
(3)反应一段时间后,可观察到D中的现象是:_________________;
(4)B中所装的溶液是:_________________溶液,起的作用是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,反应:A(s)+2B(g)![]() C(g) +D(g)。下列不能表明反应
C(g) +D(g)。下列不能表明反应
达到平衡状态的是( )。
A.气体的压强不变B.气体平均相对分子质量不变
C.气体的密度不变D.B物质的量浓度不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com