
【题目】碲(Te)被誉为尖端技术等工业的维生素。工业上常以粗铜精炼的阳极泥(主要成分是![]() ,含
,含![]() 等杂质)为原料提取碲并回收金属,其工艺流程如下图所示:
等杂质)为原料提取碲并回收金属,其工艺流程如下图所示:

已知:Te与S同一主族,比S原子多2个电子层;![]() 是两性氧化物,微溶于水。请回答要求下列问题:
是两性氧化物,微溶于水。请回答要求下列问题:
(1)碲的原子序数为___________;其最高价氧化物对应的水化物化学式为___________。该族2~5周期元素单质分别与反应生成1 mol气态氢化物的反应热如下,其中表示生成1 mol碲化氢反应热的是(填序号字母)___________。
a. +99.7![]() b. -29.7
b. -29.7![]() c. -20.6
c. -20.6![]() d. -241.8
d. -241.8![]()
(2)步骤①中发生了(填“氧化”或“还原”或“非氧化还原”)___________反应;此过程控制pH不宜过低的原因是_________;“加压”的目的是________________。
(3)步骤②当温度过高时,会导致碲的浸出率降低,原因是____________。若从滤渣X中分离出Au ,需加入某试剂,该反应的化学议程式为_________________。
(4)步骤③铜从(填“阳”或“阴”)______极得到。写出步骤④的离子方程式:_________。
【答案】52 ![]() a 氧化 防止
a 氧化 防止![]() 与酸反应 增大
与酸反应 增大![]() 浓度,加快反应速率,提高产率 使盐酸挥发,
浓度,加快反应速率,提高产率 使盐酸挥发,![]() 浓度降低 3Ag+4HNO3(稀)
浓度降低 3Ag+4HNO3(稀) ![]() 3AgNO3+NO↑+2H2O 阴
3AgNO3+NO↑+2H2O 阴 ![]()
【解析】
(1)Te是52号元素,原子最外层有6个电子,根据元素最高正化合价等于原子最外层电子数,确定最高价氧化物对应的水化物化学式;同一主族的元素形成的氢化物的稳定性逐渐减弱,物质物质含有的能量高;
(2)根据反应前后元素化合价是否发生变化判断反应类型,结合![]() 是两性氧化物,能够与酸反应判断反应条件的控制;增大压强可使氧气浓度增大,从反应速率及物质转化率分析;
是两性氧化物,能够与酸反应判断反应条件的控制;增大压强可使氧气浓度增大,从反应速率及物质转化率分析;
(3)步骤②使用的盐酸具有挥发性分析;根据硝酸具有氧化性,可以与Ag反应而不能与Au反应判断;
(4)步骤③从CuSO4溶液中获得铜单质,Cu被还原,应该从阴极得到;根据氧化还原反应原理,书写步骤④的离子方程式。
(1)Te是52号元素,原子最外层有6个电子,最高化合价为+6价,其最高价氧化物对应的水化物的化学式为H2TeO4,由于从上到下原子核外电子层数逐渐增多,元素的非金属性逐渐减弱,形成氢化物的稳定性逐渐减弱,由于物质所具有的能量越高,其稳定性就越差,所以根据选项提供的能量大小关系可知,表示生成1 mol碲化氢反应热的是+99.7kJ/mol,因此选项a合理;
(2)Cu2Te在硫酸存在时,在加热条件下与氧气发生反应:Cu2Te+2O2+2H2SO4![]() 2CuSO4+TeO2+2H2O,由于反应前后Cu、Te、O元素的化合价发生了变化,因此该反应属于氧化还原反应;在反应时溶液的pH不能过低,若pH过低,溶液的酸性过强,就会与反应产生的两性氧化物TeO2发生反应;“加压”可以增大氧气的浓度,加快化学反应速率,使反应效率大大提高;
2CuSO4+TeO2+2H2O,由于反应前后Cu、Te、O元素的化合价发生了变化,因此该反应属于氧化还原反应;在反应时溶液的pH不能过低,若pH过低,溶液的酸性过强,就会与反应产生的两性氧化物TeO2发生反应;“加压”可以增大氧气的浓度,加快化学反应速率,使反应效率大大提高;
(3)步骤②用盐酸溶解含TeO2的滤渣,由于盐酸具有挥发性,升高温度,使盐酸挥发,c(H+)浓度降低,物质溶解速率降低;用盐酸溶解后得到的滤渣X中含有Ag、Au,要分离二者,可以根据硝酸具有强氧化性,能够与Ag反应的性质,该反应的化学方程式为:3Ag+4HNO3(稀) ![]() 3AgNO3+NO↑+2H2O;
3AgNO3+NO↑+2H2O;
(4)步骤③是从CuSO4溶液中获得铜单质,Cu元素的化合价降低,被还原,发生还原反应,根据电解原理:阴极发生还原反应,所以Cu应该从阴极得到;步骤④是向TeCl4溶液中通入SO2会发生氧化还原反应,产生硫酸和Te单质,根据电子守恒、电荷守恒及原子守恒,可得该反应的离子方程式为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】化学是材料、能源、环境、信息等现代科学技术的重要基础。下列说法不正确的是
A. 制造矢量发动机使用含铼(Re)合金材料,合金是纯净物
B. “人造太阳”的核燃料是氘、氚,12H、13H互为同位素
C. 在人体中检测出了“微塑料”,说明白色污染危害严重
D. 制造芯片的工艺中,用氢氟酸腐蚀硅是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物有广泛的用途
(1)甲醇常作燃料,已知在常温常压下甲醇完全燃烧的热化学方程式如下:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH1。则2mol甲醇完全燃烧生成二氧化碳和气态水时反应的ΔH______ΔH1(填“大于”、“等于”或“小于”)
(2)煤的综合利用煤气化是将水蒸气通过红热的碳产生水煤气:C(s)+H2O(g)CO(g)+H2(g) ΔH=+131.3kJ·molˉ1,达到平衡后,下列能提高水煤气生成速率的措施是______。
A.升高温度 B.增加碳的用量 C.缩小体积 D.用CO吸收剂除去CO
(3)一定温度下,将一定量的C(s)和H2O(g)放入某恒容密闭容器中发生上述反应,得到如下数据:
达到平衡所需时间/s | 起始浓度/ mol·Lˉ1 | 平衡浓度/ mol·Lˉ1 |
H2O(g) | H2(g) | |
10 | 2.0 | 0.6 |
计算该反应从开始到平衡时,以CO表示的反应速率为______;H2O(g)的转化率为______。
(4)下列可以说明反应C(s)+H2O(g)CO(g)+H2(g)已经达到平衡状态的是____。
A.单位时间内生成nmolH2的同时,生成nmolCO
B.反应速率: (H2)= (CO)= (H2O)
C.c(H2O):c(CO):c(H2)=1:1:1
D.温度和体积一定时,混合气体的密度不再变化
E.温度和体积一定时,容器内的压强不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.

请回答下列问题:
(1)甲池为______填“原电池”、“电解池”或“电镀池”),通入 CH3OH 电极的电极反应为_____.
(2)乙池中 A(石墨)电极的名称为_____(填“正极”、“负极”或“阴极”、“阳极”),总反应式为_____.
(3)当乙池中 B 极质量增加 5.40g 时,甲池中理论上消耗 O2 的体积为_____mL(标准状况),丙池中_____极析出_____g 铜.
(4)若丙中电极不变,将其溶液换成 NaCl 溶液,电键闭合一段时间后,丙中溶液的 pH 将______________填“增大”、“减小”或“不变”);甲中溶液的 pH 将________________ (填“增大”、“减小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、F是家庭中常见的有机物,F常用于食品包装,E是石油化工发展水平的标志。根据下面转化关系回答问题。

(1)分别写出A和E中官能团的名称:A中_________;E中_________;
(2)操作⑥的名称为________________。
(3)写出反应类型:④_________;
(4)请写出下列反应的化学方程式:
①写出A和B在浓硫酸中加热反应的方程式_________________;
②B在金属铜存在下在空气中加热反应________________;
(5)F是一种常见的高分子材料,它给我们带来了巨大的方便。然而,这种材料造成的当今的某一环境问题是__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CH4与Cl2发生反应的条件是________;实验中可观察到量筒内液面________,量筒内壁出现油状液滴,其中________是工业上重要的溶剂;饱和食盐水中有少量固体析出,用饱和食盐水而不用水的原因是______________________________。

(2)在浓硫酸作用下,苯在水浴加热时可以与浓硝酸反应生成硝基苯,该反应的化学方程式为_____________
(3)写出实验室制取乙酸乙酯的化学方程式:__________________________________;实验中饱和碳酸钠溶液的作用是(填字母)________________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL ![]() 溶液中滴加
溶液中滴加![]() 的
的![]() 溶液,滴加过程中,溶液中
溶液,滴加过程中,溶液中![]() 与
与![]() 溶液体积(V)的关系如图所示,下列说法正确的是( )已知:
溶液体积(V)的关系如图所示,下列说法正确的是( )已知: ![]() 。
。
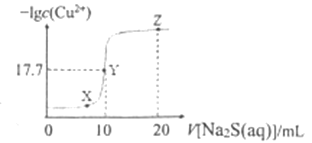
A. 该温度下 ![]()
B. X、Y、Z三点中,Y点水的电离程度最小
C. ![]() 溶液中:
溶液中:![]()
D. 向100 mL ![]() 浓度均为
浓度均为![]() 的混合溶液中逐滴加入
的混合溶液中逐滴加入![]() 的
的![]() 溶液,
溶液,![]() 先沉淀
先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂空气电池是一种用锂作负极,以空气中的氧气作为正极反应物的电池。其工作原理如图,下列说法中错误的是( )

A. 多孔电极可以提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 正极的电极反应:![]()
C. 有机电解液可以是乙醇等无水有机物
D. 充电时专用充电电极可防止空气极腐蚀和劣化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)已知:①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
则ΔH3 =________________(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2mol MoS2参加反应,则转移电子_______________mol。
(2)密闭容器中用Na2CO3(S)作固硫剂,同时用一定量氢气还原辉钼矿(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:

①由图可知,该反应的ΔH_____0(填“>”或“<”);P2__________0.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______(选填编号)。
A.v正(H2)=v逆(H2O)
B.再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为________ (计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=________________________(MPa)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com