
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)已知:①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
则ΔH3 =________________(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2mol MoS2参加反应,则转移电子_______________mol。
(2)密闭容器中用Na2CO3(S)作固硫剂,同时用一定量氢气还原辉钼矿(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:

①由图可知,该反应的ΔH_____0(填“>”或“<”);P2__________0.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______(选填编号)。
A.v正(H2)=v逆(H2O)
B.再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为________ (计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=________________________(MPa)2
【答案】ΔH1+2ΔH2 2.8 > > B 66.7% 0.01
【解析】
根据盖斯定律、化合价变化、平衡移动原理、化学平衡状态的特征进行相关的分析,要注意结合图像中的信息。
(1)已知:①2Mo(s)+3O2(g)=2MoO3(s)
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g)
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
①+②2可得③,由盖斯定律可知,则ΔH3 =ΔH1+2ΔH2。在反应③中只有O2是氧化剂,O元素从0价降到-2价,电子转移的数目为28e-,若有0.2mol MoS2参加反应,则转移电子2.8mol。
(2)①由图可知,在相同的压强下,反应物氢气的体积分数随温度的升高而减小,故该反应为吸热反应,该反应的ΔH>0;该反应为气体分子数增大的反应,在相同温度下,压强越小,氢气的转化率越大,则氢气的体积分数越小,故P2>0.1MPa。
②A.v正(H2)=v逆(H2O),能表示正反应速率和逆反应速率相等,A正确;
B.再加入MoS2不能改变其浓度,故不能使平衡发生移动,则H2转化率不变,B不正确;
C.反应前后的气体分子数不等,故当容器内气体的密度不变时,一定达平衡状态,C正确;
D. 反应前后的气体分子数不等,容器内压强不变时,一定达平衡状态
综上所述,说法错误的是B。
③由图可知M点时氢气的体积分数为25%,设氢气的起始量为4mol,转化率为α,则氢氢气的变化量为4αmol,CO和H2O的变化量分别为2αmol和4αmol,三者的平衡量分别为(4-4α)mol、2αmol和4αmol,则有![]() ,解之得α=
,解之得α=![]() ,故平衡转化率为66.7%。
,故平衡转化率为66.7%。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。M点的压强为0.1MPa,平衡混合物中,H2(g)、CO(g)、H2O(g)的体积分数分别为0.25、0.25、0.5,M点的平衡常数Kp=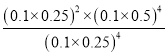 (MPa)2=0.01(MPa)2。
(MPa)2=0.01(MPa)2。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】碲(Te)被誉为尖端技术等工业的维生素。工业上常以粗铜精炼的阳极泥(主要成分是![]() ,含
,含![]() 等杂质)为原料提取碲并回收金属,其工艺流程如下图所示:
等杂质)为原料提取碲并回收金属,其工艺流程如下图所示:

已知:Te与S同一主族,比S原子多2个电子层;![]() 是两性氧化物,微溶于水。请回答要求下列问题:
是两性氧化物,微溶于水。请回答要求下列问题:
(1)碲的原子序数为___________;其最高价氧化物对应的水化物化学式为___________。该族2~5周期元素单质分别与反应生成1 mol气态氢化物的反应热如下,其中表示生成1 mol碲化氢反应热的是(填序号字母)___________。
a. +99.7![]() b. -29.7
b. -29.7![]() c. -20.6
c. -20.6![]() d. -241.8
d. -241.8![]()
(2)步骤①中发生了(填“氧化”或“还原”或“非氧化还原”)___________反应;此过程控制pH不宜过低的原因是_________;“加压”的目的是________________。
(3)步骤②当温度过高时,会导致碲的浸出率降低,原因是____________。若从滤渣X中分离出Au ,需加入某试剂,该反应的化学议程式为_________________。
(4)步骤③铜从(填“阳”或“阴”)______极得到。写出步骤④的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙烯并检验乙烯性质的装置如下图。

请回答有关问题:
(1)烧瓶中除反应物以外,还应放2-3块碎瓷片,目的是_________________;
(2)烧瓶中产生乙烯的反应方程式为:_________________,反应类型为:_________________;C中发生反应的化学方程式为:_________________,反应类型为:_________________;
(3)反应一段时间后,可观察到D中的现象是:_________________;
(4)B中所装的溶液是:_________________溶液,起的作用是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过测定混合气中O2含量可计算已变质的Na2O2 (含Na2CO3) 纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是

A. 干燥管b中装入碱石灰
B. Q气球中产生的气体主要成份O2、CO2
C. 测定气体总体积必须关闭K1、K2,打开K3
D. 读完气体总体积后,关闭K3,缓缓打开K1;可观察到Q气球慢慢缩小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厌氧性硫酸盐还原菌(SRB)是导致铁腐蚀的一种菌种,其腐蚀原理的图解如图所示。下列说法不正确的是

A. 负极产生的Fe2+向正极移动
B. ![]() 在SRB细菌作用下发生的电极反应为
在SRB细菌作用下发生的电极反应为![]() +8e-+4H2O
+8e-+4H2O![]() S2-+8OH-
S2-+8OH-
C. 总反应的化学方程式为4Fe+![]() +4H2O
+4H2O![]() FeS+3Fe(OH)2+2OH-
FeS+3Fe(OH)2+2OH-
D. 若引入新的菌种,则一定会加速金属的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3X(g)+Y(g) 2Z(g)+2W(g)在2 L密闭容器中进行,5 min时Y减少了0.5 mol,0~5 min内此反应的平均速率为
A.v(X)=0.05 mol·L1·min1
B.v(Y)=0.10 mol·L1·min1
C.v(Z)=0.10 mol·L1·min1
D.v(W)=0.05 mol·L1·s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,反应:A(s)+2B(g)![]() C(g) +D(g)。下列不能表明反应
C(g) +D(g)。下列不能表明反应
达到平衡状态的是( )。
A.气体的压强不变B.气体平均相对分子质量不变
C.气体的密度不变D.B物质的量浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯产量是衡量一个国家石油化工水平的主要标志。下图是由乙烯合成乙酸乙酯可能的合成路线:

请回答下列问题:
(1)反应④的化学方程式为_____________________________ ;
(2)在实验室制备乙酸乙酯时,用到饱和的碳酸钠溶液,其作用是:___________________;
(3)乙醇的结构式为 ,若实验证明乙醇分子有一个特殊氢原子的反应的化学方程式为 _________________________________;
,若实验证明乙醇分子有一个特殊氢原子的反应的化学方程式为 _________________________________;
(4)乙酸乙酯的同分异构体(只含一种官能团)有______________种;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,使用一对石墨电极电解饱和Na2SO4溶液,当转移2 mol电子时停止电解,析出Na2SO4·10H2O晶体m g,所有数据都在相同温度下测得,下列叙述不正确的是
A. 电解后溶液质量减少(m+18)g
B. 原溶液中Na2SO4的质量分数为![]()
C. 若其他条件不变,将石墨替换为铜电极,则阴极析出1mol H2
D. 若其他条件不变,将石墨替换为铜电极,则析出Na2SO4·10H2O晶体仍为m g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com