
【题目】尿素在生产生活中应用非常广泛,2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(l)是工业上合成氮肥尿素的主要方法,在生产条件下,单位时间内获得尿素的产量与压强及n(NH3):n(CO2)的关 系如图甲所示。当氨碳比n(NH3):n(CO2)=4 时,CO2的转化率随时间的变化关系如图乙所示。下列说法不正确的是

A.生产过程中n(NH3):n(CO2)的 最佳配比为2:1
B.若开始投料按照n(NH3):n(CO2)为2:1投料,平衡后若压缩容器的体积,则再次平衡时c(NH3)比压缩前小
C.A点的逆反应速率小于B点的正反应速率
D.由图乙可知NH3的平衡转化率为30%
【答案】B
【解析】
A.一定压强下,单位时间内的CO(NH2)2产量越高,说明n(NH3):n(CO2)的配比最佳,由图可知,生产过程中n(NH3):n(CO2)的 最佳配比为2:1,A正确;
B.2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(l),该反应的平衡常数表达式为K=![]() ,温度不变,平衡常数不变,故若开始投料按照n(NH3):n(CO2)为2:1投料,平衡后若压缩容器的体积,则再次平衡时c(NH3)与压缩前相等,B错误;
,温度不变,平衡常数不变,故若开始投料按照n(NH3):n(CO2)为2:1投料,平衡后若压缩容器的体积,则再次平衡时c(NH3)与压缩前相等,B错误;
C.当氨碳比n(NH3):n(CO2)=4 时,A点CO2的转化率小于平衡时B点对应的转化率,反应向正反应方向进行,随着反应的进行,逆反应速率逐渐增大,正反应速率逐渐减小,达到平衡时正逆反应速率相等,故A点的逆反应速率小于B点的正反应速率,C正确;
D.当氨碳比n(NH3):n(CO2)=4 时,假设n(NH3)=4amol,n(CO2)=amol,由图乙可知,平衡时CO2的转化率为60%,故达到平衡时消耗CO2的物质的量为0.6amol,2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(l),根据反应物、生成物的变化的物质的量之比等于化学计量数之比可知,达到平衡时消耗NH3的物质的量为1.2amol,所以NH3的平衡转化率为![]() =30%,D正确;
=30%,D正确;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )
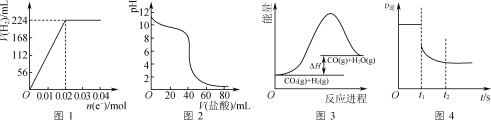
A.图1可表示电解200 mL 0.1 mol·L-1 NaCl溶液过程中,产生氢气体积(标准状况)与转移电子物质的量的关系曲线
B.图2可表示常温下0.1 mol·L-1盐酸滴加到40 mL 0.1 mol·L-1 NaOH溶液的滴定曲线
C.高温下能自发进行的反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0
CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0
D.图4可表示反应N2(g)+3H2(g)![]() 2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线
2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茶叶中铁元素的检验可经过以下四个步骤完成:将茶叶灼烧灰化→用浓硝酸溶解茶叶灰→过滤得到的滤液→检验滤液中的Fe3+.如图是可能用到的实验用品.

有关该实验的说法中正确的是( )
A. 第一步需选用仪器①、②和⑨,①的名称叫钳埚
B. 第二步用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C. 要完成第三步,需选用④、⑤和⑦,除夹持仪器外还缺滤纸
D. 第四步,若滤液中含有Fe3+,加入⑧中的溶液后滤液会显红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产生活中广泛存在。
(1)①氯胺(NH2Cl)的电子式为________。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如右表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH=_________。
化学键 | 键能/(kJ·mol-1) |
N-H | 391.3 |
Cl-Cl | 243.0 |
N-Cl | 191.2 |
H-Cl | 431.8 |
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为____________(填“放热”或“吸热”)反应。
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A)_____Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是______(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中能大量共存的是 ( )
A. 在无色溶液中: Na+ 、Fe3+、NO3- 、Cl-
B. pH=11的透明溶液中:Na+、K+、MnO4-、CO32-
C. 在含有HCO3-的溶液中:H+、K+、SO42-、Cl-
D. 含有大量Fe2+的溶液中:H+、K+、SO![]() 、NO
、NO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1molSO3(g)的ΔH=-99kJ·mol-1。请回答下列问题:
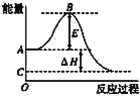
(1)图中A、C分别表示____,___,E的大小对该反应的反应热__(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点___(填“升高”或“降低”),ΔH___(填“变大”“变小”或“不变”)。
(2)图中ΔH=____kJ·mol-1。
(3)依据事实,写出下列反应的热化学方程式。
①1molN2(g)与适量H2(g)反应,生成NH3(g),放出92.2kJ热量:_____。
②1molCu(s)与适量O2(g)反应,生成CuO(s),放出157kJ热量:_____。
③在25℃、101kPa时,8 g CH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是101 kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )
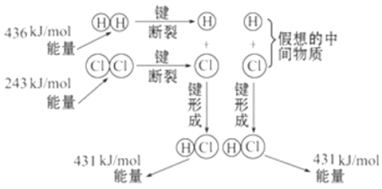
A. 1 mol H2中的化学键断裂时需要吸收436 kJ能量
B. 2 mol HCl分子中的化学键形成时要释放862 kJ能量
C. 此反应的热化学方程式为:H2(g)+Cl2(g)==2HCl(g)ΔH=+183 kJ/mol
D. 此反应的热化学方程式为:1/2H2(g)+1/2Cl2(g)==HCl(g)ΔH=-91.5 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用黄铁矿(FeS2)为原料制备硫酸的流程如下:
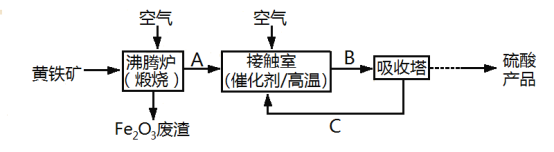
回答下列问题:
(1)在接触室中发生的反应是2SO2+O2![]() 2SO3,该反应属于__________(填字母)
2SO3,该反应属于__________(填字母)
a.氧化还原反应 b.离子反应
c.化合反应 d.可逆反应
(2)Fe2O3废渣的用途有________________________(答出一条即可)。
(3)写出沸腾炉中发生反应的化学方程式:________
(4)取硫酸产品加入蔗糖中,有“黑面包”现象发生,该过程体现出浓硫酸的性质是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I(4-对羟基苯基-2-丁酮)是国际公认的既安全又获广泛应用的合成香料。由化合物A制备I的一种合成路线如下:

回答下列问题:
(1)A的化学名称为________________。
(2)B中的官能团名称是_________________。
(3)F的结构简式为_______________。
(4)⑤的反应类型是________________。
(5)写出满足下列条件的G的同分异构体的结构简式:______________。
i.属于芳香族化合物;
ii.既能发生银镜反应,又能发生水解反应;
iii.核磁共振氢谱为三组峰,峰面积比为6︰2︰1。
(6)设计由氯乙烷和丙二酸制备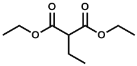 的合成路线:______(无机试剂任选)。
的合成路线:______(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com