
【题目】下列判断正确的是( )
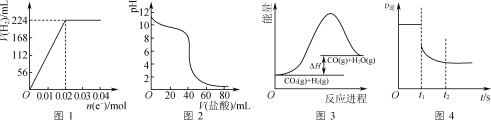
A.图1可表示电解200 mL 0.1 mol·L-1 NaCl溶液过程中,产生氢气体积(标准状况)与转移电子物质的量的关系曲线
B.图2可表示常温下0.1 mol·L-1盐酸滴加到40 mL 0.1 mol·L-1 NaOH溶液的滴定曲线
C.高温下能自发进行的反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0
CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0
D.图4可表示反应N2(g)+3H2(g)![]() 2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线
2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线
【答案】CD
【解析】
A.电解NaCl溶液时,阴极始终是水电离生成的H+被还原为H2,因此氢气的体积随着转移电子的物质的量在不断增加,A项错误;
B.常温下0.1mol/L的NaOH溶液其pH是13,因此,滴定曲线中V(盐酸)=0mL即未滴加盐酸时,溶液的pH应为13,B项错误;
C.由图可知,该反应的![]() ,该反应能在高温下自发进行,根据
,该反应能在高温下自发进行,根据![]() 可知,该反应的
可知,该反应的![]() ,C项正确;
,C项正确;
D.t1时刻扩大容器体积,相当于降低体系的压强,因此t1时刻v逆会因为压强降低而减小;根据该反应的方程式可知,降低压强会使反应平衡逆向移动,NH3的量会逐渐下降,因此v逆会进一步减小直至达到新的平衡状态,D项正确;
答案选CD。


科目:高中化学 来源: 题型:
【题目】室温下,用0.1mol·L-1的NaOH溶液分别滴定20mL、浓度均为0.1mol·L-1的HCl溶液和HCOOH溶液,溶液中由水电离出的氢离子浓度的对数[1gc(H+)水]随加入NaOH溶液体积的变化如图所示(忽略溶液体积变化),下列说法正确的是( )
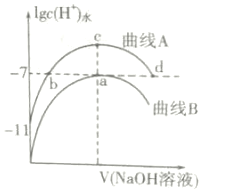
A.该温度下HCOOH的电离常数为Ka=1×10-5
B.a、c两点对应溶液同时升高相同温度,![]() 增大
增大
C.在c点溶液中有:c(HCOO-)+c(HCOOH)=0.1mol·L-1
D.在a、b、c、d四点中对应的溶液呈中性的为a、b、d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液480 mL,根据这种溶液的配制情况回答下列问题:
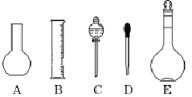
(1)如图所示的仪器中配制溶液肯定不需要的是__________ (填序号),仪器C的名称是__________,本实验所需玻璃仪器E规格为_____ mL。
(2)配制时,其正确的操作顺序是(字母表示,每个操作只用一次)__________。
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2 cm处
(3)在配制NaOH溶液实验中,若出现如下情况,其中将引起所配溶液浓度大于0.1mol/L的是_________;(填下列编号)
①容量瓶实验前用蒸馏水洗干净,但未烘干
②定容观察液面时俯视
③配制过程中遗漏了(2)中步骤A
④加蒸馏水时不慎超过了刻度,立即用胶头滴管将多余的水吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH= +49.0kJ/mol
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ΔH= -192.9kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH= -192.9kJ/mol
由上述方程式可知:CH3OH的燃烧热____(填“大于”“等于”或“小于”)192.9kJ/mol。已知水的气化热为44kJ/mol。则表示氢气燃烧热的热化学方程式为___。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH= -159.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH= +116.5kJ/mol
③H2O(l)=H2O(g) ΔH= +44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式___。
(3)已知:①Fe(s)+![]() O2(g)=FeO(s) ΔH1= -272.0kJ/mol
O2(g)=FeO(s) ΔH1= -272.0kJ/mol
②2Al(s)+![]() O2(g)=Al2O3(s) ΔH2= -1675.7kJ/mol
O2(g)=Al2O3(s) ΔH2= -1675.7kJ/mol
Al和FeO发生铝热反应的热化学方程式是___。铝热反应的反应类型___,某同学认为,铝热反应可用于工业炼铁,你的判断是____(填“能”或“不能”),你的理由____。
(4)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。已知:25℃、101KPa下:
①H2(g)+![]() O2(g)=H2O(g) ΔH1= -242kJ/mol
O2(g)=H2O(g) ΔH1= -242kJ/mol
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ΔH2= -676kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH2= -676kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
A.MgCO3![]() MgCl2(aq)
MgCl2(aq)![]() Mg
Mg
B.Cu2(OH)2CO3![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2
C.BrCH2COOH![]() HOCH2COOH
HOCH2COOH![]()
![]()
D.NH3![]() NO
NO![]() HNO3
HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是 ( )
A. 2H+(aq) +![]() (aq)+
(aq)+![]() (aq)+2
(aq)+2![]() (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H![]() O(1)
O(1) ![]() H=
H=![]() 114.6 kJ/mol
114.6 kJ/mol
B. 2KOH(aq)+ H![]() SO4(aq)= K
SO4(aq)= K![]() SO4(aq)+2H
SO4(aq)+2H![]() O(l)
O(l) ![]() H=
H=![]() 114.6kJ/mol
114.6kJ/mol
C. C8H18(l)+ ![]() O
O![]() (g)=8CO
(g)=8CO![]() (g)+ 9H
(g)+ 9H![]() O
O ![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
D. 2C8H18(g)+25O![]() (g)=16CO
(g)=16CO![]() (g)+18H
(g)+18H![]() O(1)
O(1) ![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向蛋白质溶液中加入醋酸铅溶液,产生白色沉淀 | 蛋白质发生了盐析 |
B | SO2通入Ba(NO3)2溶液中,产生白色沉淀 | 沉淀为BaSO3 |
C | 向蔗糖中加入适量浓硫酸并搅拌,蔗糖变黑,体积膨胀,并放出刺激性气味的气体 | 浓硫酸具有脱水性和强氧化性 |
D | 分别向等物质的量浓度的苯酚钠溶液和碳酸钠溶液中滴加酚酞,后者红色更深 | 碳酸酸性强于苯酚 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一个五圆环,每个环中的物质依次为FeCl3、NaCl、Na2O2、CO2、I2,图中相连的两种物质可归属为同一类,用①、②、③、④表示相交部分,请回答下列问题:
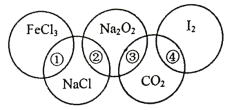
(1)关于上述相交部分的说法不正确的是___(填序号)。
A.①表示盐类 B.②表示钠的化合物
C.③表示氧化物 D.④表示非电解质
(2)关于上述相交部分的说法正确的是___(填序号)。
A.海水晒盐属于物理变化 B.Na2O2属于碱性氧化物
C.I2易溶于CCl4 D.钠着火可用CO2灭火
(3)若NaCl固体中含有少量I2杂质,可采用的除杂方法是___(填序号)
A.过滤 B.加热 C.渗析
(4)上述五种物质中,有两种物质可以发生氧化还原反应,其化学方程式为___;
(5)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1mol·L-1图中某物质M的溶液,继续煮沸得到红褐色透明液体。
①物质M的化学式为____。
②检验该红褐色透明液体是胶体的方法为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素在生产生活中应用非常广泛,2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(l)是工业上合成氮肥尿素的主要方法,在生产条件下,单位时间内获得尿素的产量与压强及n(NH3):n(CO2)的关 系如图甲所示。当氨碳比n(NH3):n(CO2)=4 时,CO2的转化率随时间的变化关系如图乙所示。下列说法不正确的是

A.生产过程中n(NH3):n(CO2)的 最佳配比为2:1
B.若开始投料按照n(NH3):n(CO2)为2:1投料,平衡后若压缩容器的体积,则再次平衡时c(NH3)比压缩前小
C.A点的逆反应速率小于B点的正反应速率
D.由图乙可知NH3的平衡转化率为30%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com