
【题目】如图为一个五圆环,每个环中的物质依次为FeCl3、NaCl、Na2O2、CO2、I2,图中相连的两种物质可归属为同一类,用①、②、③、④表示相交部分,请回答下列问题:
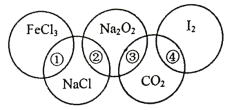
(1)关于上述相交部分的说法不正确的是___(填序号)。
A.①表示盐类 B.②表示钠的化合物
C.③表示氧化物 D.④表示非电解质
(2)关于上述相交部分的说法正确的是___(填序号)。
A.海水晒盐属于物理变化 B.Na2O2属于碱性氧化物
C.I2易溶于CCl4 D.钠着火可用CO2灭火
(3)若NaCl固体中含有少量I2杂质,可采用的除杂方法是___(填序号)
A.过滤 B.加热 C.渗析
(4)上述五种物质中,有两种物质可以发生氧化还原反应,其化学方程式为___;
(5)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1mol·L-1图中某物质M的溶液,继续煮沸得到红褐色透明液体。
①物质M的化学式为____。
②检验该红褐色透明液体是胶体的方法为___。
【答案】D AC B 2CO2+2Na2O2=2Na2CO3+O2 FeCl3 丁达尔效应
【解析】
(1)根据物质分类判断;
(2)A.海水晒盐是蒸发,没有生成新物质;
B.Na2O2与酸反应生成盐和氧气;
C.I2是非极性分子,易溶于非极性溶剂CCl4;
D. 钠着火生成过氧化钠,过氧化钠与二氧化碳反应生成氧气,从而促进钠继续燃烧;
(3)单质I2易升华。
(4)上述五种物质中,CO2与Na2O2可以发生氧化还原反应生成碳酸钠和氧气;
(5)向沸水中滴入FeCl3溶液,继续煮沸得到红褐色氢氧化铁胶体。
(1)A. FeCl3、NaCl都是盐,所以①表示盐类,故A正确;
B. NaCl、Na2O2都是含有钠的化合物,所以②表示钠的化合物,故B正确;
C. Na2O2、CO2都是氧化物,所以③表示氧化物,故C正确;
D. I2既不是电解质又不是非电解质,所以④不一定表示非电解质,故D错误;选D。
(2)A.海水晒盐是蒸发,没有生成新物质,属于物理变化,故A正确;
B.Na2O2与酸反应生成盐和氧气,所以Na2O2不是碱性氧化物,故B错误;
C.I2是非极性分子,易溶于非极性溶剂CCl4,故C正确;
D. 钠着火生成过氧化钠,过氧化钠与二氧化碳反应生成氧气,从而促进钠继续燃烧,所以不能用二氧化碳灭火,故D错误;选AC。
(3)单质I2易升华,若NaCl固体中含有少量I2杂质,可采用的除杂方法是加热升华,选B;
(4)CO2与Na2O2可以发生氧化还原反应生成碳酸钠和氧气,反应的方程式是2CO2+2Na2O2=2Na2CO3+O2;
(5)①向沸水中滴入FeCl3溶液,继续煮沸得到红褐色氢氧化铁胶体,则物质M的化学式为FeCl3。
②胶体能发生丁达尔效应,检验该红褐色透明液体是胶体的方法为丁达尔效应。


科目:高中化学 来源: 题型:
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是
A.Zn+CuSO4=ZnSO4+CuB.3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
C.AgNO3+KCl=AgCl↓+KNO3D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )
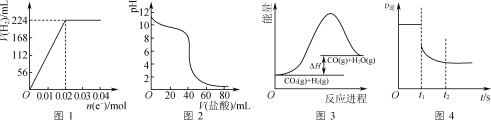
A.图1可表示电解200 mL 0.1 mol·L-1 NaCl溶液过程中,产生氢气体积(标准状况)与转移电子物质的量的关系曲线
B.图2可表示常温下0.1 mol·L-1盐酸滴加到40 mL 0.1 mol·L-1 NaOH溶液的滴定曲线
C.高温下能自发进行的反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0
CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0
D.图4可表示反应N2(g)+3H2(g)![]() 2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线
2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大。A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物是常用的食品调味剂。
回答下列问题:
(1)写出元素D在周期表中的位置____________________________________________。
(2)五种元素中,原子半径最大的是________(填元素符号),非金属最强的是________(填元素符号)。
(3)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是________(用化学式表示)。
(4)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为________,其中存在的化学键类型为_______________和________________。
(5)单质E与水反应的离子方程式为____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产铬单质涉及的反应如下:
Na2Cr2O7+2C![]() Cr2O3+Na2CO3+CO↑
Cr2O3+Na2CO3+CO↑
Cr2O3+2Al![]() 2Cr+Al2O3
2Cr+Al2O3
(1) Cr基态原子的核外电子排布式为________。
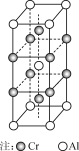
(2) Na、O、C的第一电离能从大到小的顺序为________。
(3) 与CO![]() 互为等电子体的一种分子为________(填化学式)。
互为等电子体的一种分子为________(填化学式)。
(4) Cr2O3具有两性,溶于NaOH溶液形成配合物Na[Cr(OH)4]。
Na[Cr(OH)4]中配体的化学式为____________,1 mol该配合物中含σ键数目为_________。
(5) 合金CrAl晶体的晶胞如右图所示,写出该合金的化学式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种非天然氨基酸,其合成路线如下:
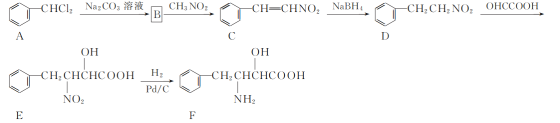
(1) C中官能团的名称为________。
(2) D→E的反应类型为________。
(3) B的分子式为C7H6O,写出B的结构简式:________。
(4) D的一种同分异构体X同时满足下列条件,写出X的结构简式: ________。
①六元环状脂肪族化合物;
②能发生银镜反应,1 mol X反应能生成4 mol Ag;
③分子中只有4种不同化学环境的氢。
(5) 写出以![]() 、CH3NO2为原料制备
、CH3NO2为原料制备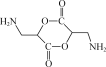 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干) _____ 。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干) _____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茶叶中铁元素的检验可经过以下四个步骤完成:将茶叶灼烧灰化→用浓硝酸溶解茶叶灰→过滤得到的滤液→检验滤液中的Fe3+.如图是可能用到的实验用品.

有关该实验的说法中正确的是( )
A. 第一步需选用仪器①、②和⑨,①的名称叫钳埚
B. 第二步用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C. 要完成第三步,需选用④、⑤和⑦,除夹持仪器外还缺滤纸
D. 第四步,若滤液中含有Fe3+,加入⑧中的溶液后滤液会显红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产生活中广泛存在。
(1)①氯胺(NH2Cl)的电子式为________。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如右表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH=_________。
化学键 | 键能/(kJ·mol-1) |
N-H | 391.3 |
Cl-Cl | 243.0 |
N-Cl | 191.2 |
H-Cl | 431.8 |
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为____________(填“放热”或“吸热”)反应。
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A)_____Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是______(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用黄铁矿(FeS2)为原料制备硫酸的流程如下:
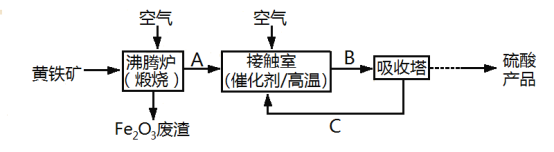
回答下列问题:
(1)在接触室中发生的反应是2SO2+O2![]() 2SO3,该反应属于__________(填字母)
2SO3,该反应属于__________(填字母)
a.氧化还原反应 b.离子反应
c.化合反应 d.可逆反应
(2)Fe2O3废渣的用途有________________________(答出一条即可)。
(3)写出沸腾炉中发生反应的化学方程式:________
(4)取硫酸产品加入蔗糖中,有“黑面包”现象发生,该过程体现出浓硫酸的性质是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com