
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
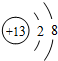 ,故答案为:第三周期ⅢA族;
,故答案为:第三周期ⅢA族;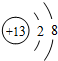 ;
; ,
, ;
;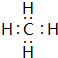 ,该分子的结构式为
,该分子的结构式为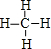 ,
,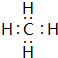 ;
;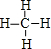 ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% | ||
B、1L浓度为1mol?L-1的Na2CO3溶液中含有2NA个
| ||
C、1L 2mol?L-1的BaCl2溶液中
| ||
D、一定温度下,1L0.50mol?L-1NaCl溶液与2L 0.25mol?L-1NaCl溶液含
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失 |
| B、锥形瓶用蒸馏水洗净后,未经干燥即进行滴定 |
| C、滴定过程中,锥形瓶中有溶液溅出 |
| D、酸式滴定管未用标准盐酸润洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、每个13755Cs含有82个中子 |
| B、CsOH的碱性比KOH的强 |
| C、HI的还原性比HF的强 |
| D、KIO3是碘的最高价含氧酸的盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 Cu、Zn、稀H2SO4形成如图甲乙装置.
Cu、Zn、稀H2SO4形成如图甲乙装置.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com