
分析 (1)Fe2(SO4)3为强酸弱碱盐,水解显酸性,铁离子水解生成氢氧化铁和氢离子;
(2)醋酸钠强碱弱酸盐,水解显碱性,醋酸根离子水解生成醋酸和氢氧根离子.
解答 解:(1)Fe2(SO4)3为强酸弱碱盐,水解显酸性,铁离子水解生成氢氧化铁和氢离子,水解离子方程式:Fe3++3H2O?Fe(OH)3+3H+;溶液显酸性;
故答案为:Fe3++3H2O?Fe(OH)3+3H+;酸;
(2)醋酸钠强碱弱酸盐,水解显碱性,醋酸根离子水解生成醋酸和氢氧根离子,水解离子方程式:CH3COO-+H2O?CH3COOH+OH-,溶液呈碱性;
故答案为:CH3COO-+H2O?CH3COOH+OH-,碱.
点评 本题考查了离子方程式的书写,侧重考查盐类水解的离子方程式,明确盐类水解实质及规律是解题关键,题目难度不大.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸在见光或受热时会发生分解 | |
| B. | 久置的浓硝酸会变为稀硝酸 | |
| C. | 金属与硝酸反应不产生氢气 | |
| D. | 稀硝酸与铁反应而浓硝酸不与铁反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
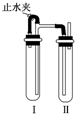 实验室制备Fe(OH)2沉淀时,由于其在空气中极易发生反应4Fe(OH)2+O2+2H2O=4Fe(OH)3.(填化学方程式)而很难观察到沉淀的颜色.为制得Fe(OH)2白色沉淀,有人设计了如图所示的装置,用NaOH溶液、铁屑、稀H2SO4等试剂制备.实验时试管Ⅰ里应加入稀H2SO4和铁屑(填试剂名称).在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是检验试管Ⅱ出口处排出的H2的纯度,当排出的H2已经纯净时再夹紧止水夹.
实验室制备Fe(OH)2沉淀时,由于其在空气中极易发生反应4Fe(OH)2+O2+2H2O=4Fe(OH)3.(填化学方程式)而很难观察到沉淀的颜色.为制得Fe(OH)2白色沉淀,有人设计了如图所示的装置,用NaOH溶液、铁屑、稀H2SO4等试剂制备.实验时试管Ⅰ里应加入稀H2SO4和铁屑(填试剂名称).在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是检验试管Ⅱ出口处排出的H2的纯度,当排出的H2已经纯净时再夹紧止水夹.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该溶液1 mL稀释至100 mL后,pH等于3 | |
| B. | 向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和 | |
| C. | 该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12 | |
| D. | 该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 用烧碱溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O | |
| C. | NH4HSO4溶液与过量NaOH稀溶液反应:NH4++OH-=NH3•H2O | |
| D. | FeBr2溶液中通入少量Cl2:2Fe2++2Br-+Cl2=2Fe3++Br2+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=1×10-7mol/L的溶液 | |
| B. | 非电解质溶于水得到的溶液 | |
| C. | 酸与碱恰好完全反应生成正盐的溶液 | |
| D. | c 2(H+)=Kw |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com